Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Ta có: m dd A = mFe2O3 (pư) + m dd H2SO4
⇒ mFe2O3 (pư) = 474 - m (g) \(\Rightarrow n_{Fe_2O_3\left(pư\right)}=\dfrac{474-m}{160}\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{m.9,8\%}{98}\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Theo PT: \(n_{H_2SO_4}=3n_{Fe_2O_3}\)
\(\Rightarrow\dfrac{9,8\%m}{98}=3.\dfrac{474-m}{160}\) \(\Rightarrow m=450\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=0,45\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,45}{3}\), ta được Fe2O3 dư.
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15.400}{474}.100\%\approx12,66\%\)
2. Sau khi cho 48 (g) Fe2O3 vào 450 (g) dd H2SO4 thu được thì trong bình chứa dd A: 0,15 (mol) Fe2(SO4)3 và 0,15 (mol) Fe2O3 dư.
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,15________0,15_______________0,3________0,3 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,1___________0,3________0,1 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
0,1___________0,1______________0,2_________0,2 (mol)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,05_________0,15________0,05 (mol)
\(SO_2+Fe_2\left(SO_4\right)_3+2H_2O\rightarrow2H_2SO_4+2FeSO_4\)
_0,05________0,05______________0,1_______0,1 (mol)
⇒ nSO2 = 0,15 + 0,1 + 0,05 = 0,3 (mol)
⇒ m dd B = 48 + 450 + 0,3.64 = 517,2 (g)
Dd B gồm: FeSO4: 0,6 (mol) và H2SO4: 0,15 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,6.152}{517,2}.100\%\approx17,63\%\\C\%_{H_2SO_4}=\dfrac{0,15.98}{517,2}.100\%\approx2,84\%\end{matrix}\right.\)
Mình bổ sung cách làm ngắn hơn cho phần 2 nhé.
2. SO2 dư → dd B có FeSO4 và H2SO4
BTNT Fe, có: nFeSO4 = 2nFe2O3 = 0,6 (mol)
BT e, có: 2nSO2 = nFeSO4 ⇒ nSO2 = 0,3 (mol)
NTNT S, có: nSO2 + nH2SO4 (ban đầu) = nFeSO4 + nH2SO4
⇒ nH2SO4 = 0,3 + 0,45 - 0,6 = 0,15 (mol)
→ B gồm: FeSO4: 0,6 (mol) và H2SO4: 0,15 (mol)
Có: m dd B = 48 + 450 + 0,3.64 = 517,2 (g)
⇒ C%

\(n_{Mg}=\dfrac{10,8}{24}=0,45\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,45-->0,45------>0,45--->0,45
=> \(m_{H_2SO_4}=0,45.98=44,1\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{44,1.100}{20}=220,5\left(g\right)\)
mdd (20oC) = 10,8 + 220,5 - 0,45.2 - 14,76 = 215,64 (g)
\(m_{MgSO_4\left(dd.ở.20^oC\right)}=\dfrac{215,64.21,703}{100}=46,8\left(g\right)\)
=> nMgSO4 (tách ra) = \(0,45-\dfrac{46,8}{120}=0,06\left(mol\right)\)
=> nH2O (tách ra) = \(\dfrac{14,76-0,06.120}{18}=0,42\left(mol\right)\)
Xét nMgSO4 (tách ra) : nH2O (tách ra) = 0,06 : 0,42 = 1 : 7
=> CTHH: MgSO4.7H2O

Bài 1:
Ta có: \(n_{Fe}=0,1\left(mol\right)\)
PT: \(Fe+4HNO_3\underrightarrow{t^o}Fe\left(NO_3\right)_3+NO+2H_2O\)
___0,1_____0,4_____0,1_______0,1 (mol)
\(\Rightarrow m_{HNO_3}=0,4.63=25,2\left(g\right)\)
\(\Rightarrow m_{ddHNO_3}=\dfrac{25,2}{6,3\%}=400\left(g\right)\)
Ta có: m dd sau pư = mFe + m dd HNO3 - mNO = 5,6 + 400 - 0,1.30 = 402,6 (g)
\(\Rightarrow C\%_{Fe\left(NO_3\right)_3}=\dfrac{0,1.242}{402,6}.100\%\approx6,01\%\)
Bạn tham khảo nhé!

nAl2O3 = 0,1 mol
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O
\(\Rightarrow C\%_{ddmuối}=\dfrac{0,1.342.100}{10,2+300}\approx11,02\%\)

\(FeS+2HCl\rightarrow FeCl_2+H_2S\)\(\uparrow\)
0.2 0.2
\(H_2S+4H_2O\rightarrow H_2SO_4+4H_2\)
0.2 0.2 0.8
a. \(n_{FeS}=\dfrac{17.6}{88}=0.2mol\)
\(mdd_{H_2SO_4}=m_X=m_{H_2S}+m_{H_2O}-m_{H_2}=0.2\times34+92.3-0.8\times2=97.5g\)
\(C\%_{H_2SO_4}=\dfrac{0.2\times98\times100}{97.5}=20,1\%\)
b. \(\dfrac{1}{2}dd_X\Rightarrow n_X=0.1mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0.2 0.1
\(mdd_{NaOH}=\dfrac{0.2\times40\times100}{20}=40g\)
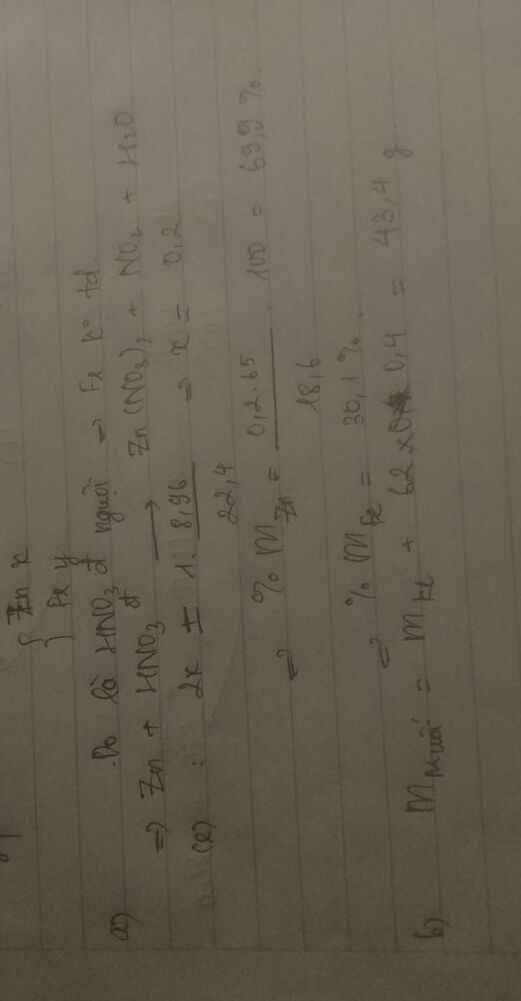

\(n_{Fe_2O_3}=\frac{2,4}{160}=0,015\left(mol\right)\)
PTHH : Fe2O3 + 3H2SO4 -----> Fe2(SO4)3 + 3H2O
(mol) 0,015 0,045 0,015
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,045\times400=18\left(g\right)\)
\(\Rightarrow\%Fe_2\left(SO_4\right)_3=\frac{18}{300}\times100=6\%\)