Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng có Al dư do phản ứng với NaOH tạo H2
=> nAl dư = 2/3 .nH2 = 0,02 mol
Sau phản ứng có Al và Al2O3 + NaOH => NaAlO2
Bảo toàn Al ta có :
2nAl2O3 sau nung= nAl dư + 2nAl2O3 => nAl2O3 = 0,04 mol
=>nAl ban đầu = 0,1 mol
Do các phản ứng hàn toàn , mà khi nhiệt nhôm Al dư => oxit sắt hết
=>D chỉ có Fe
=>Bảo toàn e : 3nFe = 2nSO2 => nFe = 0,08 mol
Bảo toàn khối lượng : mA = mB = mFe + mAl + mAl2O3 = 9,1g
=>%mAl(A) = 29,67% gần nhất với giá trị 24%
=>A

Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g

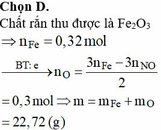



Chọn đáp án B
Ø Chia, tách nhỏ từng bài tập, quá trình ra để giải:
¨ chỉ có Al + NaOH → NaAlO2 + 3/2H2/uparrow || nNaOH = nH2 = 0,12 mol
⇒ chứng tử sau phản ứng NaOH còn dư 0,04 mol và ∑nAl trong A = 0,08 mol.
Khí B như ta biết gồm CO2 (sinh ra do FeCO3) và H2 (do Fe)
10 gam kết tủa là 0,1 mol CaCO3 ⇒ có 0,1 mol CO2 ⇒ nFeCO3 = 0,1 mol.
Rắn R ra chắc chắn có Cu và có thể là còn dư kim loại Fe. Vậy phần trong dung dịch?
À, gồm: 0,08 mol AlCl3; 0,12 mol NaCl + ??? mol FeCl2. Mà ∑nHCl = nHCl = 0,74 mol
⇒ bảo toàn Cl có ngay nFeCl2 = 0,19 mol; sinh ra do 0,1 mol FeCO3 ⇒ còn 0,09 nữa do Fe.
Vậy mR = mCu, Fe lọc ra = 20 – mAl – mFeCO3 – mFe phản ứng = 1,2 gam.
R gồm Cu, Fe là các kim loại hoạt động TB yếu nên + HNO3 sinh NO hoặc NO2.
ở đây dùng HNO3 đặc nên khí duy nhất sinh ra là NO2 || nNO2 = 0,05 mol
⇒ bảo toàn electron có 3nFe + 2nCu = nNO2 = 0,05 mol mà mFe + Cu = 1,2 gam
⇒ giải ra nFe = nCu = 0,01 mol. Đọc tiếp quá trình cuối
⇒ m gam sản phẩm gồm 0,01 mol CuO và 0,05 mol Fe2O3 ⇒ m = 1,6 gam → chọn đáp án B