Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNO = 2,24/22,4 = 0,1 (mol)
PTHH: 3R + 8HNO3 (loãng) -> 3R(NO3)2 + 2NO + 4H2O
nR(NO3)2 = nR = 3/2 . 0,1 = 0,15 (mol)
M(R) = 9,6/0,15 = 64 (g/mol)
=> R là Cu
mCu(NO3)2 = 0,15 . 188 = 28,2 (g)

nNO = 2,25/22,4 = 0,1 (mol)
PTHH: R + 4HNO3 -> R(NO3)3 + NO + 2H2O
nR = nR(NO3)3 = nNO = 0,1 (mol)
MR = 2,7/0,1 = 27 (g/mol)
<=> R là nhôm (Al)
Muối thu được: Al(NO3)3
mAl(NO3)3 = 0,1 . 213 = 21,3 (g)

a) Gọi số mol Fe, Cr là a, b (mol)
=> 56a + 52b = 10,8 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a---->a------------------->a
Cr + H2SO4 --> CrSO4 + H2
b--->b------------------->b
=> a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Fe=\dfrac{0,1.56}{10,8}.100\%=51,85\%\\\%Cr=\dfrac{0,1.52}{10,8}.100\%=48,15\%\end{matrix}\right.\)
b) \(n_{H_2SO_4}=a+b=0,2\left(mol\right)\)
=> \(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
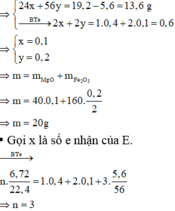
=> Khí E là NO

a) Gọi số mol Cu, Pb là a, b (mol)
=> 64a + 207b = 14,34 (1)
\(n_{NO}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Cu0 - 2e --> Cu+2
a-->2a
Pb0 - 2e --> Pb+2
b-->2b
N+5 +3e --> N+2
0,18<--0,06
Bảo toàn e: 2a + 2b = 0,18 (2)
(1)(2) => a = 0,03; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Cu}==\dfrac{0,03.64}{14,34}.100\%=13,39\%\\\%m_{Pb}=\dfrac{0,06.207}{14,34}.100\%=86,61\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,03\left(mol\right)\\n_{Pb\left(NO_3\right)_2}=0,06\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Cu\left(NO_3\right)_2}=0,03.188=5,64\left(g\right)\\m_{Pb\left(NO_3\right)_2}=0,06.331=19,86\left(g\right)\end{matrix}\right.\)

nH2 = 0.115 (mol)
2A + 2nH2O => 2A(OH)n + nH2
0.23/n__________________0.115
MA = 8.97/0.23/n = 39n
BL : n = 1 => A = 39
A là : Kali
mKOH = 0.23*56 =12.88 (g)
mdd thu được = 8.97 + 100 - 0.115*2 = 108.74(g)
C% KOH = 12.88/108.74 *100% = 11.84(g)
c)
nCO2 = 3.36/22.4 = 0.15 (mol)
nKOH / nCO2 = 0.23/0.15 = 1.53
=> tạo ra 2 muối
Đặt :
nK2CO3 = a (mol)
nKHCO3 = b (mol)
2KOH + CO2 => K2CO3 + H2O
KOH + CO2 => KHCO3
nKOH = 2a + b = 0.23
nCO2 = a +b = 0.15
=>a = 0.08
b = 0.07
mK2CO3 = 0.08*138 = 11.04 (g)
mKHCO3 = 100* 0.07 = 7 (g)
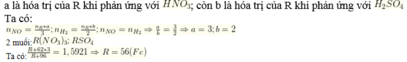
$R + H_2SO_4 \to RSO_4 + H_2$
$n_R = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$M_R = \dfrac{16,8}{0,3} =56(Fe)$
Vậy R là Sắt
$n_{FeSO_4} = n_{H_2} = 0,3(mol)$
$m_{FeSO_4} = 0,3.152 =45,6(gam)$