Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
ti le 1 : 2 : 1 : 1
n(mol) 0,5-->1--------->0,5------>0,5
\(m_{FeCl_2}=n\cdot M=0,5\cdot\left(56+35,5\cdot2\right)=63,5\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,5\cdot22,4=11,2\left(l\right)\)

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)

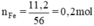
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
\(n_{Cl2\left(dktc\right)}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
a) Pt : \(2Al+3Cl_2\underrightarrow{t_o}2AlCl_3|\)
2 3 2
0,02 0,04 0,04
Lập tỉ số so sánh : \(\dfrac{0,02}{2}< \dfrac{0,04}{3}\)
⇒ Al phản ứng hết , Cl2 dư
⇒ Tính toán dựa vào số mol của Al
b) \(n_{AlCl3}=\dfrac{0,02.2}{2}=0,02\left(mol\right)\)
⇒ \(m_{AlCl3}=0,02.133,5=2,67\left(g\right)\)
\(n_{Cl2\left(dư\right)}=0,04-\left(\dfrac{0,02.3}{2}\right)=0,01\left(mol\right)\)
⇒ \(m_{Cl2}=0,01.71=0,71\left(g\right)\)
Chúc bạn học tốt

nCl2= 3,36/22,4=0,15(mol)
a) PTHH: 2 Fe + 3 Cl2 -to->2 FeCl3
b) nFe= 2/3. nCl2 = 2/3. 0,15=0,1(mol)
=>mFe=0,1.56=5,6(g)
=>m=5,6(g)
Số mol của khí clo ở dktc
nCl2= \(\dfrac{V_{Cl}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : 2Fe + 3Cl2 → 2FeCl3\(|\)
2 3 2
0,1 0,15
b) Số mol của sắt
nFe = \(\dfrac{0,05.3}{2}=0,1\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,1 . 56
= 5,6 (g)
Chúc bạn học tốt

\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(0.1.......0.15..........0.1\)
\(V_{Cl_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(m_{FeCl_3}=0.1\cdot162.5=16.25\left(g\right)\)

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4\cdot36,5=14,6g\)
\(a=m_{ddHCl}=\dfrac{14,6}{14,6\%}\cdot100\%=100g\)
\(V_{H_2}=0,2\cdot22,4=4,48l\)
\(m_{ZnCl_2}=0,2\cdot136=27,2g\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ n_{Cl_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ n_{FeCl_3}=n_{Fe}=0,2\left(mol\right)\\ a,V_{Cl_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,m_{FeCl_3}=162,5.0,2=32,5\left(g\right)\)
a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{FeCl_3}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)
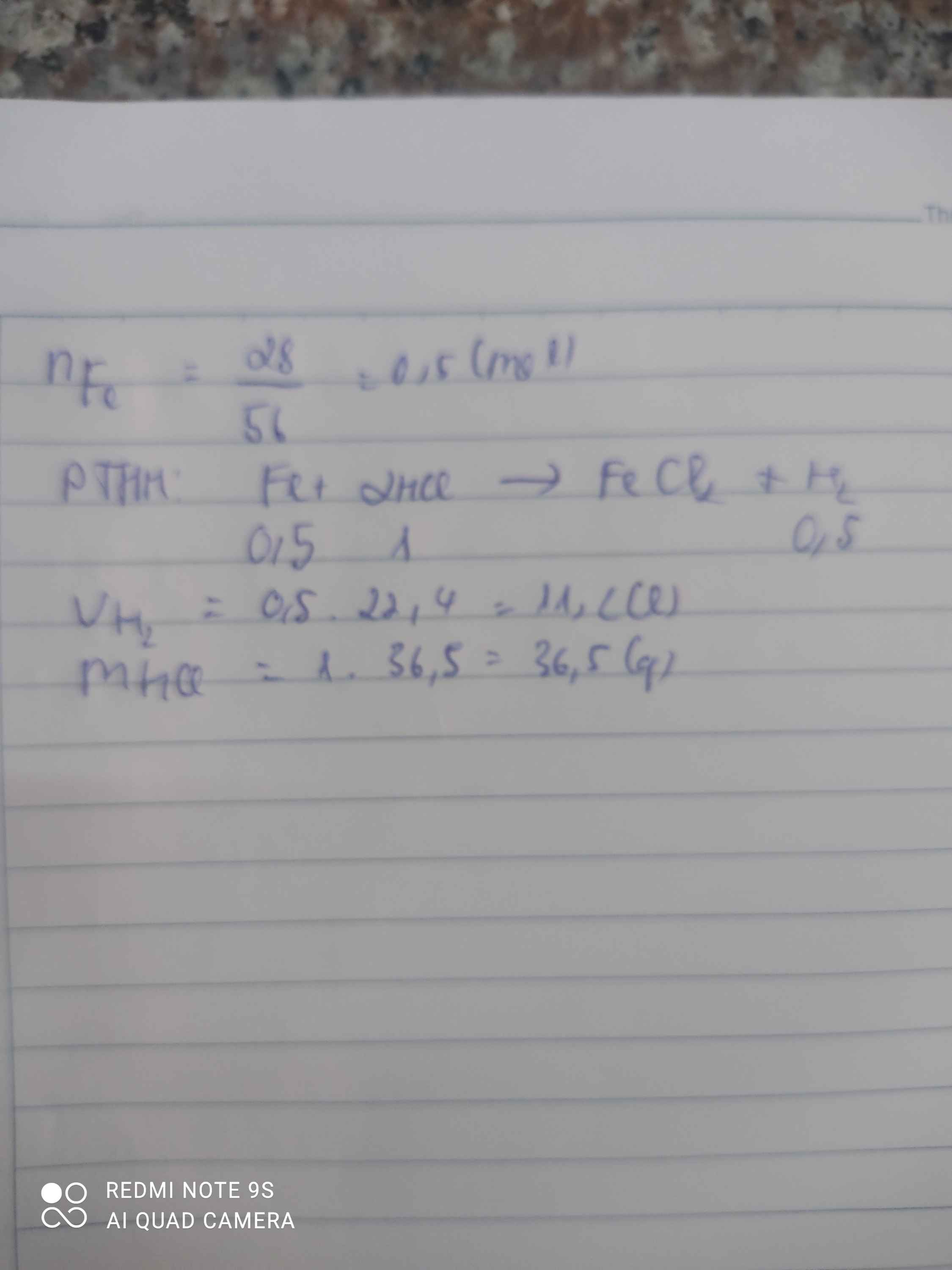
PTHH: 2Fe + 3Cl2 → 2FeCl3
Số mol của Fe là: 11,2 : 56 = 0,2 mol
Số mol của Cl2 là: 0,2 . 3/2 = 0,3 mol
Thể tích của Cl2 là: 0,3 . 22,4 = 6,72 lít
Số mol của FeCl3 là : 0,2 . 2/2 = 0,2 mol
Khối lượng sản phẩm thu đc là: 0,2 . 162,5 gam
n Fe=0,2 mol
PTHH: 2Fe+3Cl2=>2FeCl3
0,2-> 0,3->0,2
=> V Cl2=0,3.22,4=6,72ml
mFeCl3=0,2.162,5=32,5g