Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Dung dịch chỉ chứa một chất tan duy nhất ⇒ nH+ = nOH- = 0,05
⇒ x = 0,5

Đáp án C
Ta có : n K H C O 3 = 0,1 mol ; n K 2 C O 3 = 0,1 mol
n N a H C O 3 = 0,1mol; n N a 2 C O 3 = 0,1 mol
Dung dịch X có: n C O 3 2 - = 0,2 mol; n H C O 3 - = 0,2 mol
n H 2 S O 4 = 0,1 mol; nHCl = 0,1 mol
→ n H + = 0,1.2+0,1= 0,3 mol; n S O 4 2 - = 0,1 mol
Nhỏ từ từ dung dịch Y vào dung dịch X ta có:
CO32-+ H+ → HCO3- (1)
0,2 0,2 0,2 mol
Sau pứ (1) ta thấy: n H C O 3 - = 0,2+ 0,2 = 0,4 mol;
n H + = 0,3- 0,2 = 0,1 mol
HCO3- + H+ → CO2+ H2O
0,4 0,1 → 0,1 mol
→V = V C O 2 = 0,1.22,4 = 2,24 lít

Đáp án B

Nên 2 muối tạo thành là Na2HPO4 và Na3PO4
Chú ý: Với tư duy giải bài trắc nghiệm, các bạn nên xét ngay trường hợp thứ 2, khi có kết quả phù hợp kết luận được ngay đáp án đúng, nếu không thì thu ngay được đáp án D. Với dạng bài này, kết qủa thường rơi vào trường hợp thứ 2 vì sẽ áp dụng quy luật n N a O H = n H 2 O (do 1 OH- trong NaOH kết hợp với 1 H+ trong axit tạo thành 1 phân tử H2O hoặc có thể viết các phương trình phản ứng để quan sát).

Đáp án B
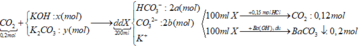
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> nH+ = nOH- + 2nCO2 > 0,12.2 = 0,24 (mol)
=> loại vì nH+ = 0,15 (mol)
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x →x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)

=> a – 3b = 0 (1)
BTNT C: nBaCO3 = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X : nHCO3- = 0,3 (mol) ; nCO32- = 0,1 (mol)
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: nCO2(bđ) + nK2CO3 = nHCO3-+ nCO32- => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: nK+ = nKOH + 2nK2CO3 => nKOH = 0,5 – 2.0,2 = 0,1 (mol)
=> x = 0,1 (mol)


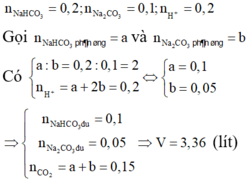
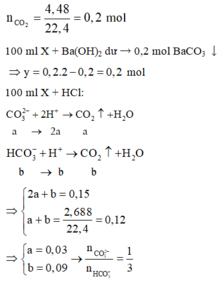
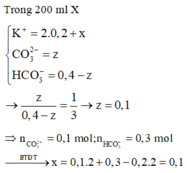


Tham Khảo
Gọi số mol HCl là x mol
nKOH = V.CM = 0,1.1 = 0,1 mol;
PTHH: KOH + HCl → KCl + H2O (1)
1. Nếu KOH phản ứng hết, HCl có thể hết hoặc dư.
Theo PTHH (1): nKCl = nKOH = 0,1 mol.
⇒ mKCl = n.M = 0,1.74,5 = 7,45 gam > 6,525 gam.
⇒ Điều giả sử là sai, KOH dư và HCl phản ứng hết.
2. HCl hết, KOH dư.
Gọi nHCl = x mol.
Theo PTHH (1): nKCl = nHCl = x mol.
nKOH tgpư = nHCl = x mol ⇒⇒ nKOH dư = 0,1-x (mol).
Các chất tan có trong dd sau phản ứng gồm: KCl (x mol), KOH: (0,1-x mol).
Ta có: 6,525 = 74,5x + 56.(0,1-x) ⇒ x = 0,05.
⇒ CM (ddHCl) = n/V = 0,05/0,1 = 0,5M
Tham Khảo
Gọi số mol HCl là x mol
nKOH = V.CM = 0,1.1 = 0,1 mol;
PTHH: KOH + HCl → KCl + H2O (1)
1. Nếu KOH phản ứng hết, HCl có thể hết hoặc dư.
Theo PTHH (1): nKCl = nKOH = 0,1 mol.
⇒ mKCl = n.M = 0,1.74,5 = 7,45 gam > 6,525 gam.
⇒ Điều giả sử là sai, KOH dư và HCl phản ứng hết.
2. HCl hết, KOH dư.
Gọi nHCl = x mol.
Theo PTHH (1): nKCl = nHCl = x mol.
nKOH tgpư = nHCl = x mol ⇒⇒ nKOH dư = 0,1-x (mol).
Các chất tan có trong dd sau phản ứng gồm: KCl (x mol), KOH: (0,1-x mol).
Ta có: 6,525 = 74,5x + 56.(0,1-x) ⇒ x = 0,05.
⇒ CM (ddHCl) = nVnV = 0,050,10,050,1 = 0,5M