Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mBr2 = 120.20/100 = 24g nBr2 = 0,15 mol =>nankan = nanken = nBr2 = 0,15 mol
Gọi CTPT của ankan và anken là CnH2n+2 và CnH2n
=>nCO2 = 0,15n + 0,15n = 20 , 6 22 , 4 ⇒ n = 3
=>Chọn A.

Đáp án A
Vkhí anken bị hấp thụ = 40%VX
C4H10 -> anken + ankan
=> Butan dư => Vbutan = 20%VX
nanken = nBr2 = 0,16 mol
=> nC4H10 bđ = 0,16 + 0,16.50% = 0,24 mol
manken = mCH2 = 5,6g => nCH2 = 0,4 mol
Bảo toàn C : 4nC4H10 – nCH2 = nC(ankan) = nCO2 = 0,56 mol

Vì nanken = nankan ⇒ MX = 36= (M Anken + M Ankan) /2 (1)
nX = 0,3 ⇒ nAnkan = nAnken = 0,15
nBr2 = 0,1 < 0,15 ⇒ n khí thoát ra gồm 0,15 mol Ankan và 0,05 Anken
khí thoát ra có tỷ khối so với H2 là 20
⇒ 0,15.M Ankan + 0,05.MAnken = 20.2.(0,15+0,05) (2)
Từ (1) và (2) ⇒ M Ankan = 44 ; M Anken = 28
⇒ Ankan là C3H8 và Anken là C2H4.
Đáp án C

nCO2 = 0,4 mol
CnH2n + \(\dfrac{3n}{2}\)O2 \(\underrightarrow{t^o}\) nCO2 + nH2O
\(\dfrac{0,4}{n}\) .0,4
ta có : MCnH2n = \(\dfrac{5,6n}{0,4}\) = 14n
↔ n=1(loại)
do n≥ 2

Hỗn hợp X gồm 5 chất: do có 60% thể tích X thoát ra tác dụng với Br2 nên sẽ có 40% anken, 40% (C3H6,C2H4) và 20% C4H10
n
Br
2
=
0
,
16
=> số mol anken là 0,16 nên số mol C4H10 là 0,08
Gọi số mol của C3H6,CH4 là x, số mol của C2H6,C2H4 là y
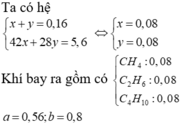
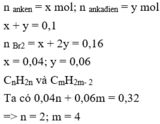

Câu1: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-1-en thu được 52,8gam CO2 và 21,6 gam nước.Giá trị của a là:
A.18,8g
B.18,6g
C.16,8g
D.16,4g
Câu2: Anken X có % khối lượng cacbon là 85,71%.Công thức phân tử của X không là :
A. C3H6
B.C2H4
C.CH2
D.C4H8
Câu3: Áp dụng quy tắc Macconhicop vào trường hợp nào sau đây?
A.Phản ứng cộng của Br2 với anken đối xứng.
B.Phản ứng cộng của HX vào anken đối xứng.
C.Phản ứng trùng hợp của anken
D.Phản ứng cộng của HX vào anken bất đối xứng.