Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ:
- Phân tử O2
Khi hình thành liên kết hoá học trong phân tử O2, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Phân tử O2 được biểu diễn như sau:


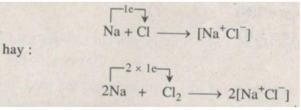
Ta đã biết natri là một kim loại có khuynh hướng nhường electron để trở thành một ion dương có cấu hình electron vững bền và clo là một phi kim có khuynh hướng nhận electron để trở thành một ion âm có cấu hình electron vững bền. Vì vậy khi cho clo tiếp xúc với natri thì trước hết có hiện tượng chuyển electron từ nguyên tử Na sang nguyên tử Cl. Từ đó xuất hiện các ion tích điện khác dấu (âm và dương) và sau đó do lực hút tĩnh điện giữa các ion nên liên kết ion được hình thành.
Phản ứng hoá học giữa natri và clo có thể được diễn tả bằng phương trình hoá học :

Mình sẽ làm mẫu với 2 CTHH đầu, bạn tư duy làm tiếp những CTHH sau nhé!
- Đầu tiên là với NaCl thì sơ đồ hình thành liên kết ion sẽ như thế này!
+ Sơ đồ hình thành liên kết:
\(Na\rightarrow Na^++1e\\ Cl+1e\rightarrow Cl^-\)
+ Các ion hút nhau bằng lực hút tĩnh điện:
\(Na^++Cl^-\rightarrow NaCl\)
- VD cho hợp chất Al2O3
+ Sơ đồ hình thành liên kết:
\(2Al\rightarrow2Al^{3+}+2.3e\\ 3O+3.2e\rightarrow3O^{2-}\)
+ Sự hợp thành hợp chất nhờ lực hút tĩnh điện:
\(2Al^{3+}+3O^{2-}\rightarrow Al_2O_3\)
