Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
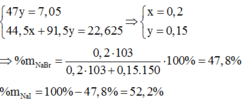

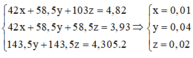
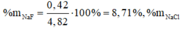
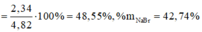
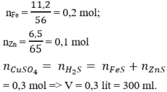

Câu 2:
\(\left\{{}\begin{matrix}n_{SO2}=0,5\left(mol\right)\\n_{KOH}=0,6\left(mol\right)\end{matrix}\right.\)
Vì \(\frac{n_{KOH}}{n_{SO2}}=\frac{0,6}{0,5}=1,2\) nên sản phẩm có K2SO3 và KHSO3
Gọi \(\left\{{}\begin{matrix}n_{K2SO3}=a\left(mol\right)\\n_{KHSO3}=b\left(mol\right)\end{matrix}\right.\)
PTHH :
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
2a _____a _______a _______(mol)
\(KOH+SO_2\rightarrow KHSO_3\)
b_____b_________b______ (mol)
\(\left\{{}\begin{matrix}n_{KOH}=2a+b=0,6\\n_{SO2}=a+b=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{K2SO3}=0,1.158=15,8\left(g\right)\\m_{KHSO3}=0,4.120=48\left(g\right)\end{matrix}\right.\)
Câu 3:
\(n_{Na2SO3}=0,6\left(mol\right)\)
PTHH :
\(Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\)
\(\Rightarrow n_{SO2}=n_{Na2SO3}=0,6\left(mol\right)\)
Để cần tối thiểu NaOH thì muối sinh ra là muối axit ( NaHSO3)
\(NaOH+SO_2\rightarrow NaHSO_3\)
0,6 ______0,6_________
\(\Rightarrow V_{NaOH}=\frac{0,6}{1}=0,6\left(l\right)\)
Câu 4:
\(n_S=0,05\left(mol\right)\)
\(S+O_2\underrightarrow{^{to}}SO_2\)
0,05_______0,05_(mol)
a. Thí nghiệm 1 :
\(n_{SO2}=\frac{0,05}{2}=0,025\left(mol\right)\)
\(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\)
0,025_____________0,025___________(mol)
\(\Rightarrow m_{kt}=m_{CaSO3}=0,025.120=3\left(g\right)\)
b. \(n_{Ca\left(OH\right)2}=0,4.0,05=0,02\left(mol\right)\)
Vì \(\frac{n_{SO2}}{n_{Ca\left(OH\right)2}}=\frac{0,025}{0,02}=1,25\) nên sản phẩm tạo muối CaSO3 và Ca(HSO3)2
\(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
\(Ca\left(OH\right)_2+2SO_2\rightarrow Ca\left(HSO_3\right)_2\)
- Hiện tượng : có kết tủa trắng xuất hiện