Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.Trong các hiđrohalogenua, tính khử tăng theo thứ tự sau:
a) HF<HCl<HBr<HI
b) HCL<HI<HBR<HF
c) HF<HBR<HCL<HI
d) HI< HBr<HCL<HF
2) A
Do nguyên tử I có bán kính lớn nhất trong các halogen nên liên kết H-I là dài nhất trong các liên kết H-X của hidro halogenua \(\rightarrow\) Liên kết dễ bị phá vỡ nhất vì vùng xen phủ ở xa hạt nhân nhất\(\rightarrow\) H trong HI dễ dàng bị tách ra tạo ion H+. Vậy HI có tính axit mạnh nhất.
3) D
Trong nhóm halogen, flo có độ âm điện lớn nhất nên dễ dàng hút e về phía mình tạo ion F-. Vậy F2 có tính oxh lớn nhất.

Câu 13: Bột vôi sống (CaO), bột gạo, bột thạch cao (CaSO4.2H2O), bột đá vôi (CaCO3). Thuốc thử dùng để nhận biết bột gạo:
A. dung dịch HCl
B. dung dịch H2SO4
C. dung dịch Br2
D. dung dịch I2
Câu 14: dung dịch axit nào sau đây không thể chứa trong bình thủy tinh:
A. HCl
B. H2SO4
C. HNO3
D. HF

Câu 2: Chỉ dùng một thuốc thử nhận biết các chất đựng riêng biệt trong các lọ mất nhãn sau: NaCl, NaF, NaBr, NaI
cho AgNo3 vào từng mẫu thử
NaBr kết tủa vàng nhạt
NaI kết tủa vàng cam
NaCl kết tủa trắng
NaF không kết tủa
Câu 3: Viết phương trình hóa học chứng minh tính oxi hóa của Cl2 > Br2 > I2
a, Cl2 + NaBr → Br2 + NaCl và Br2 + NaI → I2 + NaBr
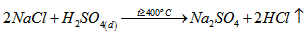
Câu 4: Giải thích tại sao: a, Khi điều chế khí hiđro clorua phải dùng muối NaCl tinh thể và axit H2SO4 đậm đặc b, Không dùng bình thủy tinh để đựng dung dịch HF
Phải dùngH2SO4đặc và muối ở trạng thái tinh thể để hiđro clorua tạo thành không hoà tan trong nước.
ko dùng bình thủy tinh để đựng dd HFvì HF có thể td với thủy tinh
bài 6
2Al+6HCl----.2AlCl3 +3H2(1)
x-------3x---------x------1,5x
Fe+2HCl----.>FeCl2+H2(2)
y------2y------------y------y
Ta có
nH2=8,96/22,4=0,4(mol)
Ta có hệ pt
{27x+56y=111,5
x+y=0,4⇒{x=0,2,y=0,1
%mAl=Al=0,2.27/11.100%=49,09%
%mFe=100−49,09=50,91%
b) Theo pthh
nHCl=2nH2=0,8(mol)
mHCl=0,8.36,5=29,2(g)
mdd=29,2.100/10=292(g)
câu 7
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

Fe+2HCl->FeCl2+H2
x---2x-----------x
Mg+2HCl->MgCl2+H2
y------2y-----------y
Ta có :
\(\left\{{}\begin{matrix}56x+24y=24\\x+y=\dfrac{13,44}{22,4}\end{matrix}\right.\)
=>x=0,3 mol, y=0,3 mol
=>%m Fe=\(\dfrac{0,3.56}{24}.100\)=70%
=>%m Mg=100-70=30%
=>VHCl=\(\dfrac{0,3.2+0,3.2}{2}\)=0,6l=600ml
b)
XCl2+2AgNO3->2AgCl+X(NO3)2
0,6--------------------1,2mol
=>m AgCl=1,2.143,5=172,2g

Câu 1:
PTHH: \(Na+\dfrac{1}{2}Cl_2\xrightarrow[]{t^o}NaCl\)
Ta có: \(n_{NaCl}=2n_{Cl_2}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\)
Câu 2:
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\) \(\Rightarrow m_{H_2}=0,04\cdot2=0,08\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\) \(\Rightarrow m_{HCl}=0,08\cdot36,5=2,92\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=4,29\left(g\right)\)
Mình sửa lại nha
Câu 18: Tính axit của các axit halogenhiđric HX được sắp xếp giảm dần theo thứ tự
A. HF > HCl > HBr > HI. B. HI >HBr >HCl > HF
C. HCl > HBr> HI > HF. D. HBr> HCl >HI >HF
17B
18B
19B
20C