Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{56}{22,4}=2,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,5\left(mol\right)\\n_{C_2H_2}=1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,5.22,4}{33,6}.100\%\approx33,33\%\\\%V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=3,5\left(mol\right)\Rightarrow m_{O_2}=3,5.32=112\left(g\right)\)

a. Phương trình phản ứng :
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
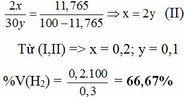
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.

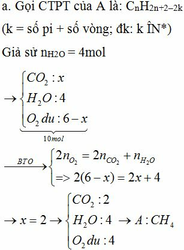
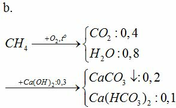
pt:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 → 0,3 0,3
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,1 → 0,1 0,1
m dd tăng = mCO2 + mH2O – mCaCO3 = 12g

Giải:
Gọi số mol của H2 là x; CH4 là y
Ta có: \(n_X=x+y=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Lại có: \(\dfrac{d_X}{O_2}=0,325\Rightarrow M_X=0,325.32=10,4\left(g\right)\)
Mà \(M_X\dfrac{m_X}{n_X}=\dfrac{2x+16y}{0,5}=10,4\)
\(\Rightarrow\left\{{}\begin{matrix}2x+16y=5,2\\x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: \(CH_4+2O_2\rightarrow CO_2+2H_2O\) (1)
0,3 mol......................................0,6mol
\(2H_2+O_2\rightarrow2H_2O\) (2)
0,2mol.............0,1mol
Từ PTHH (1) và (2)
\(n_{O_2pư}=0,1+0,6=0,7\left(mol\right)\)
Theo bài ra: \(n_{O_2}=\dfrac{28,8}{32}=0,9\left(mol\right)\)
\(\Rightarrow n_{O_2dư}=0,9-0,7=0,2\left(mol\right)\)
Mà % về thể tích cũng là % về số mol
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,5}.100\%=40\%\\\%V_{CO_2}=100\%-40\%=60\%\end{matrix}\right.\)
=> Trong Y gồm O2 dư và CO2
Theo PTHH (1)
\(n_{CO_2}=n_{CH_4}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{0,2}{0,2+0,3}.100\%=40\%\\\%V_{CO_2}=100\%-40\%=60\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CO_2}=\dfrac{0,3.44}{0,2.32+0,3.44}.100\%\approx67,35\%\\\%m_{O_2}=100\%-67,35\%=32,65\%\end{matrix}\right.\)

Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6

a) PTHH: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
b) Đặt \(n_{CH_4}=x\left(mol\right);n_{C_2H_4}=y\left(mol\right)\). Khi đó \(22,4x+22,4y=4,48\) \(\Leftrightarrow x+y=0,2\)
Từ PTHH \(\Rightarrow n_{O_2\left(1\right)}=2x\left(mol\right)\)\(;n_{O_2\left(2\right)}=3y\left(mol\right)\). Khi đó \(2x.22,4+3y.22,4=11,2\) \(\Leftrightarrow2x+3y=0,5\)
Vậy ta có \(\left\{{}\begin{matrix}x+y=0,2\\2x+3y=0,5\end{matrix}\right.\Leftrightarrow x=y=0,1\left(mol\right)\)
\(\Rightarrow\%V_{CH_4}=\%V_{C_2H_4}=50\%\)

a, Hỗn hợp A gồm CO và CO2.
Gọi: \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{CO_2}=y\left(mol\right)\end{matrix}\right.\)
Có: dA/O2 = 1,25 ⇒ MA = 1,25.32 = 40 (g/mol)
\(\Rightarrow\dfrac{28x+44y}{x+y}=40\Rightarrow y=3x\) (1)
Ở cùng điền kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{x}{x+y}.100\%=\dfrac{x}{x+3x}.100\%=25\%\\\%V_{CO_2}=75\end{matrix}\right.\)
b, Ta có: \(n_{CaCO_3}=\dfrac{6}{100}=0,06\left(mol\right)\)
BTNT C, có: nC = nCO + nCO2 = nCaCO3 ⇒ x + y = 0,06 (2)
⇒ m = 0,06.12 = 0,72 (g)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,015\left(mol\right)\\y=0,045\left(mol\right)\end{matrix}\right.\)
BTNT O, có: 2nO2 = nCO + 2nCO2 ⇒ nO2 = 0,0525 (mol)
\(\Rightarrow V_{O_2}=0,0525.22,4=1,176\left(l\right)\)