Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Br_2}=0,2.0,1=0,02\left(mol\right)\\ n_{HC}:n_{Br_2}=0,01:0,02=1:2\\ \Rightarrow X:C_2H_2\left(Ankin\right)\\ Chọn.B\)

\(n_{Br_2}=0,1.0,1=0,01\left(mol\right)=n_X\)
Vậy \(X\)là hidrocacbon không no, tác dụng với \(Br_2\) theo tỉ lệ \(1\div1\)nên \(X\) là anken.

Gọi công thức của ba hiđrocacbon đó là : C x H y , C a H b , C n H m
Khi đốt ta có :
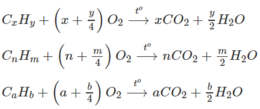
Vì số mol CO 2 tạo ra bằng 2 lần số mol hiđrocacbon đem đốt. Vậy theo phương trình hoá học của phản ứng cháy
→ X = a = n = 2.
Mặt khác : A không làm mất màu nước brom → không có liên kết đôi hoặc ba. Vậy A là CH 3 - CH 3
1 mol B chỉ tác dụng tối đa với 1 mol brom → có 1 liên kết đôi.
Vậy B là CH 2 = CH 2
1 mol C tác dụng tối đa với 2 mol brom → có liên kết ba.
Vậy C là CH ≡CH.

Gọi: \(\left\{{}\begin{matrix}n_{C_3H_8}=a\left(mol\right)\\n_{C_xH_y}=2a\left(mol\right)\\n_{C_xH_{2x}}=3a\left(mol\right)\end{matrix}\right.\) (trong 16,128 (l))
\(\Rightarrow a+2a+3a=\dfrac{16,128}{22,4}=0,72\left(mol\right)\Rightarrow a=0,12\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{C_3H_8}=0,12\left(mol\right)\\n_{C_xH_y}=0,24\left(mol\right)\\n_{C_xH_{2x}}=0,36\left(mol\right)\end{matrix}\right.\)
Ta có: m bình 1 tăng = mH2O \(\Rightarrow n_{H_2O}=\dfrac{56,16}{18}=3,12\left(mol\right)\)
BTNT H, có: 0,12.8 + 0,24y + 0,36.2x = 3,12.2 (1)
Ta có: \(n_{Ba\left(OH\right)_2}=2.1,19=2,38\left(mol\right)\), \(n_{BaCO_3}=\dfrac{394}{197}=2\left(mol\right)\)
BTNT Ba, có: \(n_{Ba\left(HCO_3\right)_2}=2,38-2=0,38\left(mol\right)\)
BTNT C, có: 0,12.3 + 0,24.x + 0,36.x = nCO2 = nBaCO3 + 2nBa(HCO3)2 = 2 + 0,38.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=4\\y=10\end{matrix}\right.\)
Vậy: CTPT cần tìm là C4H10 và C4H8.
Hỗn hợp T gồm 2 hidrocacbon → T gồm C3H8 và C4H10.
→ Chỉ C4H8 pư với Br2.
Ta có: \(n_{C_4H_8}=n_{Br_2}=0,18\left(mol\right)\)
\(\Rightarrow n_{C_3H_8}=\dfrac{0,18}{3}=0,06\left(mol\right)\)
\(n_{C_4H_{10}}=\dfrac{0,18}{3}.2=0,12\left(mol\right)\)
⇒ mZ = mC3H8 + mC4H10 + mC4H8 = 0,06.44 + 0,12.58 + 0,18.56 = 19,68 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{C_3H_8}=\dfrac{0,06.44}{19,68}.100\%\approx13,41\%\\\%m_{C_4H_{10}}=\dfrac{0,12.58}{19,68}.100\%\approx35,37\%\%\\\%m_{C_4H_8}\approx51,22\%\end{matrix}\right.\)
nBr2 = 0,2.0,1 = 0,02 (mol)
X pư với Br2 theo tỉ lệ mol 1 : 2
=> X có CTPT dạng CnH2n-2