Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)

a. Gọi a (mol) và b (mol) lần lượt là số mol của Cu và Fe trong hồn hợp ban đầu. Số mol khí SO2 sinh ra là 10,08:22,4=0,45 (mol).
Ta có: 64a+56b=20,8 (1).
BTe: 2a+3b=2.0,45 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra a=0,15 và b=0,2.
%mCu=0,15.64/20,8.100%\(\approx\)46,15%, %mFe\(\approx\)100%-46,15%\(\approx\)53,85%.
b. Số mol NaOH tối thiểu cần dùng là 0,45 mol (chỉ tạo muối NaHSO3).
Thể tích cần tìm là 0,45:2=0,225 (lít)=225 (ml).
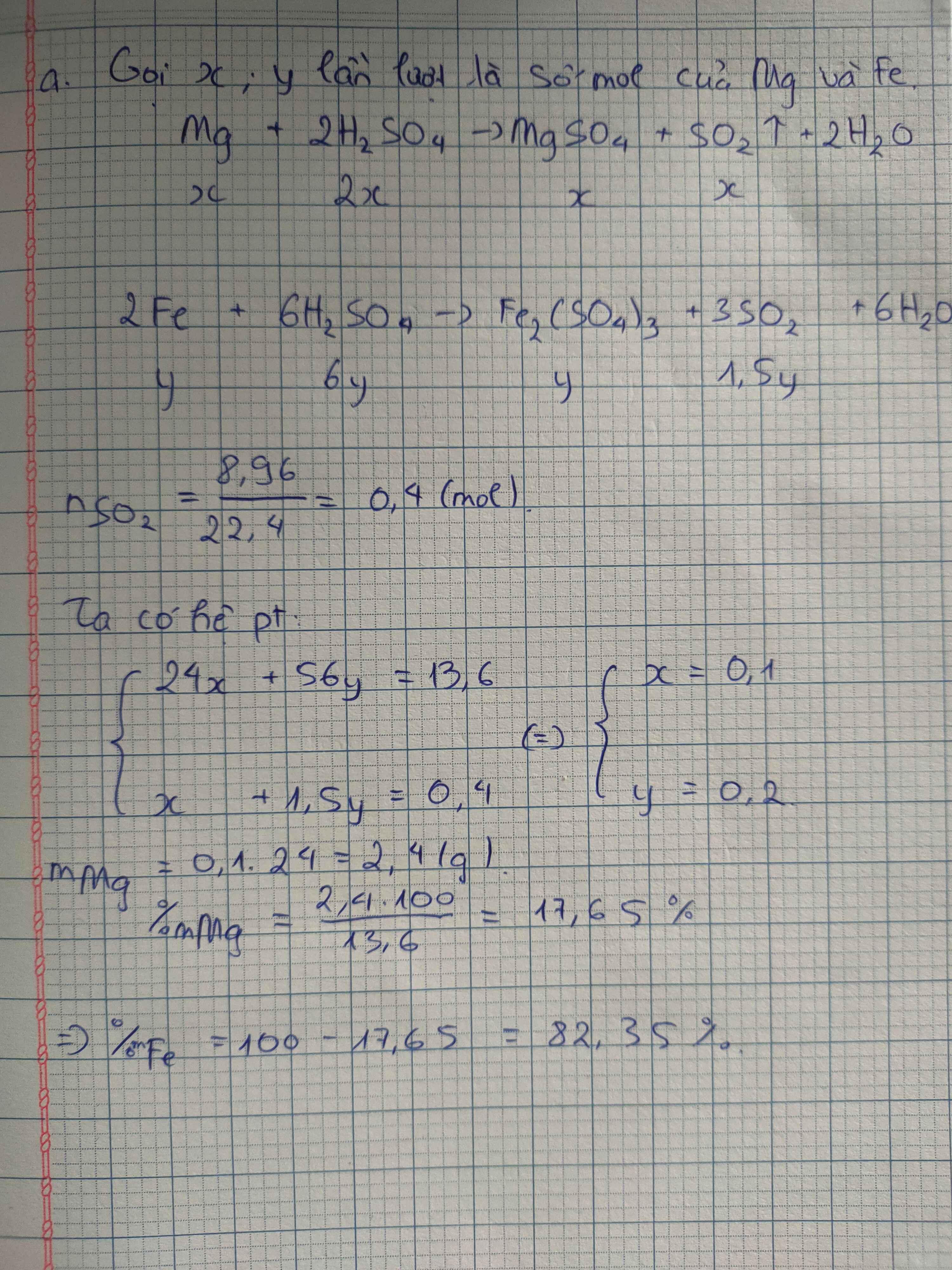




Bài 1.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_S=\dfrac{4,8}{32}=0,15mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
0,2 < 0,15 ( mol )
0,15 0,15 0,15 ( mol )
X gồm FeS và Fe(dư)
\(\left\{{}\begin{matrix}m_{FeS}=0,15.88=13,2g\\m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8g\end{matrix}\right.\)
\(Fe+HCl\rightarrow FeCl_2+H_2\)
0,05 0,05 ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
0,15 0,15 ( mol )
\(V_{hh}=V_{H_2}+V_{H_2S}=\left(0,05+0,15\right).22,4=4,48l\)
Bài 2.
\(n_{SO_2}=\dfrac{2,688}{22,4}=0,12mol\)
\(M+nH_2SO_4\left(đ\right)\rightarrow\left(t^o\right)\dfrac{1}{2}M_2\left(SO_4\right)_n+\dfrac{n}{2}SO_2+nH_2O\)
\(\dfrac{0,24}{n}\) \(0,12\) ( mol )
\(\rightarrow\dfrac{0,24M_M}{n}=7,68\)
\(\Leftrightarrow M_M=32n\)
Xét:
n=1 --> Lưu huỳnh ( loại )
n=2 --> Cu ( nhận )
n=3 --> Loại
Vậy kim loại đó là Cu
\(n_{NaOH}=2.0,5=1mol\)
\(T=\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{1}{0,12}=8,3\) --> Tạo ra muối Na2SO3
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
0,12 0,12 ( mol )
\(C_{M_{Na_2SO_3}}=\dfrac{0,12}{0,5}=0,24M\)
cho em hỏi là cái Vdd Na2SO3 ở đâu ra vậy ạ, em cảm ơn!