Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\\
m_{H_2SO_{\text{ 4}}}=\dfrac{100.9,8}{100}=9,8g\\
n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\\
pthh:Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
0,1 0,1
\(m_{\text{dd}}=10,2+100-\left(0,3.18\right)=104,8g\\
C\%=\dfrac{0,1.342}{104,8}.100\%=32,633\%\)
\(a,n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\\ m_{H_2SO_4}=9,8\%.100=9,8\left(g\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Ban đầu: 0,1 0,1
Phản ứng: \(\dfrac{1}{30}\) 0,1
Sau pư: \(\dfrac{1}{15}\) 0 \(\dfrac{1}{30}\) 0,1
b, \(\rightarrow m_{dd}=\dfrac{1}{30}.102+100=103,4\left(g\right)\)
\(\rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{1}{30}.342}{101,6}.100\%=11,22\%\)

\(a,PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\\ \left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên H2SO4 dư
\(\Rightarrow n_{BaSO_4}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\\ b,n_{HCl}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,25\cdot36,5=9,125\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{9,125}{441,75}\cdot100\%\approx2,07\%\)

\(a,\left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\\ PTHH:H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4\downarrow\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên sau phản ứng \(H_2SO_4\) dư
\(\Rightarrow n_{BaSO_4}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\)
\(b,n_{HCl}=2n_{BaCl_2}=0,5\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,5\cdot36,5=18,25\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{18,25}{441,75}\cdot100\%\approx4,13\%\)

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
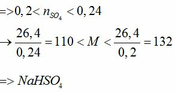
b)
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{H_2SO_4}=147.10\%=14,7\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,1 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) ⇒ Zn hết, H2SO4 dư
b) \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) mdd sau pứ = 6,5 + 147 - 0,1.2 = 153,3 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,1.161.100\%}{153,3}=10,502\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,15-0,1\right).98.100\%}{153,3}=3,196\%\)

Bài 4 :
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
b) \(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(C_{ddHCl}=\dfrac{14,6.100}{100}=14,6\)0/0
d) \(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(m_{ddspu}=13+100-\left(0,2.2\right)=112,6\left(g\right)\)
\(C_{ZnCl2}=\dfrac{27,2.100}{112,6}=24,16\)0/0
Chúc bạn học tốt
Bài 3 :
\(n_{Mg}=\dfrac{12}{24}=0,5\left(mol\right)\)
a) Pt : \(Mg+H_2SO_4\rightarrow MgSO_4+H_2|\)
1 1 1 1
0,5 0,5 0,5 0,5
b) \(n_{H2}=\dfrac{0,5.1}{1}=0,5\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,5.22,4=11,2\left(l\right)\)
c) \(n_{H2SO4}=\dfrac{0,5.1}{1}=0,5\left(mol\right)\)
⇒ \(m_{H2SO4}=0,5.98=49\left(g\right)\)
\(C_{ddH2SO4}=\dfrac{49.100}{200}=24,5\)0/0
d) \(n_{MgSO4}=\dfrac{0,5.1}{1}=0,5\left(mol\right)\)
⇒ \(m_{MgSO4}=0,5.120=60\left(g\right)\)
\(m_{ddspu}=12+200-\left(0,5.2\right)=211\left(g\right)\)
\(C_{MgSO4}=\dfrac{60.100}{211}=28,44\)0/0
Chúc bạn học tốt

nCuO=2,4/80=0,03(mol)
m(H2SO4)=29,4%.100=29,4(g) -> nH2SO4=29,4/98=0,3(mol)
a) PTHH: CuO + H2SO4 -> CuSO4 + H2O
Ta có: 0,03/1 < 0,3/1
b)=> CuO hết, H2SO4 dư => Tính theo nCuO
nH2SO4(p.ứ)=nCuSO4=nCuO=0,03(mol)
=>nH2SO4(dư)=0,3-0,03=0,27(mol)
=>mH2SO4(dư)=0,27. 98= 26,46(g)
b) mCuSO4=0,03.160= 4,8(g)
mddsau= 2,4+ 100=102,4(g)
C%ddCuSO4= (4,8/102,4).100=4,6875%
C%ddH2SO4(dư)= (26,46/102,4).100= 25,84%
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{29,4.100}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
a) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,03 0,3 0,03
b) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
Số mol dư của axit sunfuric
ndư = nban đầu - nmol
= 0,3 - (0,03 . 1)
= 0,27 (mol)
Khối lượng dư của axit sunfuric
mdư = ndư . MH2SO4
= 0,27 . 98
= 26,46 (g)
c) Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
Khối lượng của đồng (II) sunfat
mCuSO4 = nCuSO4 . MCuSO4
= 0,03 . 160
= 4,8 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + mH2SO4
= 2,4 + 100
= 102,4 (g)
Nồng độ phần trăm của đồng (II) sunfat
C0/0CuSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,8.100}{102,4}=4,6875\)0/0
Nồng độ phần trăm của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{26,46.100}{102,4}=25,84\)0/0
Chúc bạn học tốt