Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A: MgO, Al2O3,CuO, Cu
C:MgCl2, AlCl3,CuCl2, HCl
D: Cu
E: MgCl2,AlCl3, FeCl2
F: Fe, Cu
H: FeCl2, HCl
I: H2
K: Mg(OH)2, Fe(OH)2
CuO+H2→Cu+H2O
CuO+2HCl→CuCl2+H2O
MgO+2HCl→MgCl2+H2O
Al2O3+6HCl→2AlCl3+3H2O
Fe+CuCl2→FeCl2+Cu
Fe+2HCl→FeCl2+H2
MgCl2+2NaOH→Mg(OH)2+2NaCl
FeCl2+2NaOH→2NaCl+Fe(OH)2
AlCl3+4NaOH→NaAlO2+3NaCl+2H2O

Đặt \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Fe_2O_3}=y\left(mol\right)\end{matrix}\right.\Rightarrow56x+160y=4,8\left(1\right)\)
\(PTHH:Fe+CuSO_4\rightarrow FeSO_4+Cu\\ \Rightarrow n_{Cu}=n_{Fe}=a\left(mol\right)\\ Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ Cu+2FeCl_3\rightarrow CuCl_2+2FeCl_2\\ \Rightarrow n_{Cu}=\dfrac{1}{2}n_{FeCl_3}=n_{Fe_2O_3}=b\left(mol\right)\\ \Rightarrow n_{Cu\left(dư\right)}=a-b=\dfrac{3,2}{64}=0,05\left(mol\right)\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=\dfrac{8}{135}\\b=\dfrac{1}{108}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\%_{Fe}=\left(\dfrac{8}{135}\cdot56\right):4,8\cdot100\%\approx69,14\%\\\%_{Fe_2O_3}\approx30,86\%\end{matrix}\right.\)
\(b,n_{HCl}=6n_{Fe_2O_3}=\dfrac{1}{18}\approx0,06\left(mol\right)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,06}{1}=0,06\left(l\right)\)

2H(Axit) + O(Oxit) → H2O
→ nH(Axit) = 2.nO(Oxit)
Gọi số mol của Fe3O4 và CuO lần lượt là x và y
BTNT O: 4x + y = 0,6
BTKL: 56 . 3x + 64y = 29,6
=> x = 0,1 và y = 0,2
=> %Fe3O4 = 59,18%
%CuO = 40,82%

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a/ Số mol của HCl = 0,425 x 2 = 0,85mol
Gọi x, y lần lượt là số mol của Al, Mg trong hỗn hợp
Giả sử kim loại phản ứng hết
2Al + 6HCl ===> 2AlCl3 + 3H2
x...........3x...............................1,5x
Mg + 2HCl ===> MgCl2 + H2
y..........2y...............................y
Lập các sô mol trên phương trình, ta có
27x + 24y = 7,5 <=> 27x + 18y < 7,5
<=> (3x + 2y ) x 9 < 7,5 => 3x + 2y < 0,833 (mol) < 0,85
Vì số mol HCl phản ứng bé hơn số mol HCl đầu, nên HCl dư
b/ Chuyển m (gam) CuO thành (m - 5,6) gam chất rắn => Giảm 5,6 gam
Vậy nCuO(pứ) = nO(bị khử) = 5,6 / 16 = 0,35 mol
H2 + CuO =(nhiệt)==> Cu + H2O
0,35...0,35(mol)
Ta có: \(\begin{cases}27x+24y=7,5\\1,5x+y=0,35\end{cases}\)
=> \(\begin{cases}x=0,1\\y=0,2\end{cases}\)
=> mAl = 0,1 x 27 = 2,7 gam
mMg = 7,5 - 2,7 = 4,8 gam
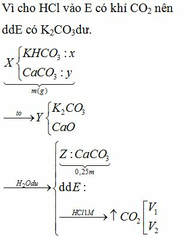
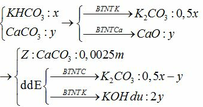
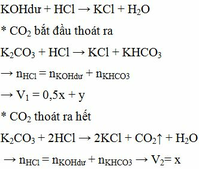
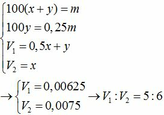

PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\) (1)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\) (4)
a) Có 12,8 g chất rắn không tan \(\Rightarrow m_{Cu}=12,8\left(g\right)\)
\(\Rightarrow n_{Cu}=n_{CuO}=\dfrac{12,8}{64}=0,2\left(mol\right)\) \(\Rightarrow m_{CuO}=0,2\cdot80=16\left(g\right)\)
Mặt khác: \(n_{H_2\left(3\right)}=\dfrac{5,376}{22,4}=0,24\left(mol\right)=n_{Fe}\)
\(\Rightarrow n_{Fe_2O_3}=0,12\left(mol\right)\) \(\Rightarrow m_{Fe_2O_3}=0,12\cdot160=19,2\left(g\right)\)
\(\Rightarrow m_{MgO}=41,2-16-19,2=6\left(g\right)\)
b) Ta có: \(n_{MgO}=\dfrac{6}{40}=0,15\left(mol\right)\)
Theo PTHH (3) và (4): \(\left\{{}\begin{matrix}n_{HCl\left(3\right)}=2n_{Fe}=0,48\left(mol\right)\\n_{HCl\left(4\right)}=2n_{MgO}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(p/ứ\right)}=0,78\left(mol\right)\) \(\Rightarrow\Sigma n_{HCl}=0,78\cdot120\%=0,936\left(mol\right)\)
Theo đề, cứ 100 g dd HCl thì chứa 18,25 g HCl
\(\Rightarrow C\%_{HCl}=18,25\%\) \(\Rightarrow m_{ddHCl}=\dfrac{0,936\cdot36,5}{18,25\%}=187,2\left(g\right)\)
Mình cảm ơn ạ