Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{12,32}{22,4}=0,55mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi x, y lần lượt là số mol của Fe và Al:
\(\left\{{}\begin{matrix}56x+27y=13,7\\x+2y=0,55\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.mol\)
\(\%m_{Fe}=\dfrac{0,15.56}{13,7}.100\%=61,31\%\)

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 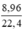 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 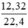 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
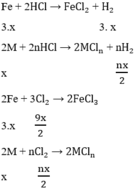
Theo bài ra ta có hệ phương trình:
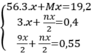
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
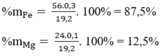

đề cho có bị sai số liệu không?
Thể tích khí Cl2 sao lại là 13,32(l) ????

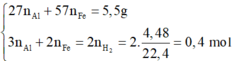
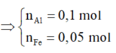
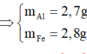

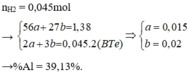



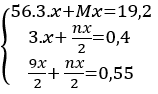
nFe = a (mol)
nAl = b (mol)
=> 56a + 27b = 8.3 (1)
nH2 = PV/RT = 8.4*1 / 0.082 * (136.5 + 273) = 0.25 (mol)
Fe + 2HCl => FeCl2 + H2
2Al + 6HCl => 2AlCl3 + 3H2
nH2 = a + 1.5b = 0.25 (mol) (2)
(1) , (2) :
a = b = 0.1
%Fe = 0.1*56/8.3 * 100% = 67.47%
%Al = 32.53%