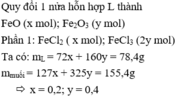Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi X thành \(\left\{{}\begin{matrix}FeO:a\left(mol\right)\\Fe_2O_3:b\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{Fe^{2+}}=a\left(mol\right)\\n_{Fe^{3+}}=2b\left(mol\right)\end{matrix}\right.\)
=> \(\dfrac{a}{2b}=\dfrac{1}{2}\) => a = b
Phần 1: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
=> 127.0,5a + 162,5b = m1
=> m1 = 226a (g)
Phần 2: \(\left\{{}\begin{matrix}FeCl_2:0,5a\left(mol\right)\\FeCl_3:b\left(mol\right)\end{matrix}\right.\)
PTHH: 2FeCl2 + 3Cl2 --> 2FeCl3
0,5a------------->0,5a
=> 162,5(0,5a + b) = m2
=> m2 = 243,75a (g)
Mà m2 - m1 = 0,71
=> 243,75a - 226a = 0,71
=> a = 0,04 (mol)
Y chứa \(\left\{{}\begin{matrix}FeCl_2:0,04\left(mol\right)\\FeCl_3:0,08\left(mol\right)\end{matrix}\right.\)
Bảo toàn Cl: nHCl = 0,32 (mol)
=> \(V_{dd.HCl}=\dfrac{0,32}{2}=0,16\left(l\right)\)

1/2m hỗn hợp= 39,2
m muối tăng= mSO4-mCl
do nso4(2-)=1/2ncl-(bảo toàn điện tích hoặc có thể viết pt ra là thấy)
83,95-77,7=96.1/2.ncl-35,5ncl
ncl bị thay thế là 0,5
có ở phần 77,7. có btkluong 39,2+36,5.2.a=77.7+18a(a là n h20)
a=0,7 ----- tổng ncl = 1,4
n kloai là 77,7-1,4.35.5=28 ----- nfeo là x fe2o3 y (ở nửa phần) có 56x+112y=28......72x+160y=39,2
x=0,1 y=0,2
%feo=18,36...... fe203=81,64%
b, ncl còn lại=nhcl=1,4-0,5=0,9
nso4=1/2ncl=0.25=nh2so4
CM=(0,25+0,9)/0,5=2,3

Ta có:
m hh phần 1 = m hh phần 2 = 38,6 ( g )
Phần 1
Gọi n HCL phản ứng = a ( mol )
=> n H2O = 0,5a ( mol )
BTKL: 38,6 + 36,5a = 78,2 + 9a
=> a = 1,44 ( mol ) => n O ( hh phần 1 ) = 0,72 ( mol )
=> m O ( hh phần 1 ) = 11,52 ( g ) => m KL ( hh phần 1 ) = 27,08 ( g )
Phần 2
Quy hh phần 2 về: RO
PTHH
RO + 2HCl ===> RCL2 + H2O ( 1 )
RO + H2SO4 ===> RSO4 + H2O ( 2)
Gọi n RO ( 1 ) = x ( mol ) ; n RO ( 2 ) = y ( mol )
CÓ: m gốc CL + m gốc SO4 = 88,7 - 27,08 = 61,62 ( g )
Ta có hpt
\(\left\{{}\begin{matrix}x+y=0,72\\2x\times35,5+96y=61,62\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,42\end{matrix}\right.\)
Có: y = 0,42 ( mol ) = > n H2SO4 = 0,42 ( mol )

Cho m gam hỗn hợp X gồm FeO, Fe2O3 , Fe3O4 vào một lượng vừa đủ d
Link tham khảo :

1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)