Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)

a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

Gọi \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+H_2SO_{4l}\rightarrow FeSO_4+H_2\)
0,2 0,2
\(\Rightarrow n_{Fe}=0,2mol\Rightarrow m_{Fe}=0,2\cdot56=11,2g\)
Phần 2:
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(BTe:2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,8\)
\(\Rightarrow n_{Cu}=\dfrac{0,8-3\cdot0,2}{2}=0,1mol\)
\(\Rightarrow m_{Cu}=0,1\cdot64=6,4g\)
Vậy \(m_X=m_{Cu}+m_{Fe}=6,4+11,2=17,6g\)

P1 :\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: nH2 = nFe = 0,1 mol
P2 :2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (1)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (2)
Ta có: \(\dfrac{3}{2}.0,1\) + nSO2(2) = 0,4 mol
=> x = 0,1 ; y = 0,25 mol
Do chia 2 hỗn hợp X thành phần bằng nhau nên trong gam X có: 0,2 mol Fe và 0,5 mol Cu
=> \(\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,3.64}.100=36,84\%\)
%m Cu=63,16%



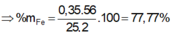

1/2m hỗn hợp= 39,2
m muối tăng= mSO4-mCl
do nso4(2-)=1/2ncl-(bảo toàn điện tích hoặc có thể viết pt ra là thấy)
83,95-77,7=96.1/2.ncl-35,5ncl
ncl bị thay thế là 0,5
có ở phần 77,7. có btkluong 39,2+36,5.2.a=77.7+18a(a là n h20)
a=0,7 ----- tổng ncl = 1,4
n kloai là 77,7-1,4.35.5=28 ----- nfeo là x fe2o3 y (ở nửa phần) có 56x+112y=28......72x+160y=39,2
x=0,1 y=0,2
%feo=18,36...... fe203=81,64%
b, ncl còn lại=nhcl=1,4-0,5=0,9
nso4=1/2ncl=0.25=nh2so4
CM=(0,25+0,9)/0,5=2,3