Giúp mik làm 1 khi đốt cháy hoàn toàn m gam kim loại m hóa trị 3 trong bình chứa 6.72 lít khí cl2 (đkc) vừa đủ thì thu được 26.7 gam muối. Xác dinh tên kim loại M tính m 2 đun nóng hỗn hợp gồm 4.6 gam Na và 4.8 gam S tính khoi lượng các chất hỗn hợp sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn A.
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.

Chọn đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol. Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M. Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n ⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg) ⇒ chọn C.

Đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol.
Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||
⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M.
Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n
⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg)

Mol SO2=2,688/22,4=0,12 mol
M \rightarrow M+2 +2e
0,12 mol<= 0,24 mol
S+6 +2e \rightarrow S+4
0,24 mol<=0,12 mol
=>0,12M=7,68=>M=64 M là Cu
b) mol O2=2,24/22,4=0,1 mol
Mol hhB=4,256/22,4=0,19 mol
2SO2 + O2 \rightleftharpoons 2SO3
Bđ:0,12 mol;0,1 mol
Pứ::x mol=>0,5x mol=>x mol
Sau:0,12-x mol;0,1-0,5x mol;x mol
Molhh B=0,12-x+0,1-0,5x+x=0,19=>x=0,06 mol
Vậy hh B gồm 0,06 mol SO2 0,07 mol O2 0,06 mol SO3 =>%V
c) mol Fe=6,72/56=0,12 mol
Mol Cu=7,84/64=0,1225 mol
mcr sau pứ=8,8g>mCu=>Cu chưa pư vs axit, Fe pứ 1phần
Fe \rightarrow Fe+3 +3e
x mol. => 3x mol
S+6 +2e \rightarrow S+4
3x mol=>1,5x mol
2Fe3+ + Fe \rightarrow 3Fe2+
x mol=>0,5 x mol
Fe dư:0,12-1,5x mol=>mFe=6,72-84x
mcr=8,8=6,72-84x+7,84=>x=0,06857 mol=>mol SO2=0,103 mol=>V=2,304l

Câu 1
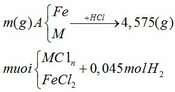
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
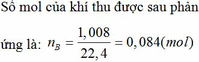
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
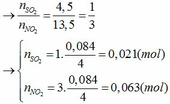
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
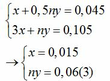
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Bài 1:
Ta có: \(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo ĐLBT KL, có: mM + mCl2 = m muối
⇒ mM = 26,7 - 0,3.71 = 5,4 (g)
PT: \(2M+3Cl_2\underrightarrow{t^o}2MCl_3\)
___0,2____0,3 (mol)
\(\Rightarrow M_M=\dfrac{5,4}{0,2}27\left(g/mol\right)\)
Vậy: M là Nhôm (Al).
Bạn tham khảo nhé!
Bài 2:
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PT: \(2Na+S\underrightarrow{t^o}Na_2S\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\), ta được S dư.
Theo PT: \(n_{Na_2S}=n_{S\left(dư\right)}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow n_{S\left(dư\right)}=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na_2S}=0,1.78=7,8\left(g\right)\\m_{S\left(dư\right)}=0,05.32=1,6\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!