Hỗn hợp X gồm 0,7 mol C2H5OH và 0,8 mol một hợp chất hữu cơ A (RCOOH).Cho dd H2SO4 đặc vào X, đun nóng một thời gian thu đc hỗn hợp Y. Để trung hòa hết axit dư trong Y cần 200ml dd NaOH 2M. Cô cạn hỗn hợp sau phản ứng trung hòa thu đc 38,4g muối khan
a) tính hiệu suất phhanr ứng este hóa trên
b)tính khối lượng este có trong Y



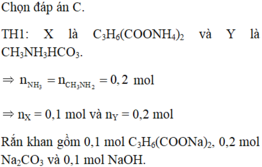
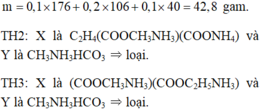

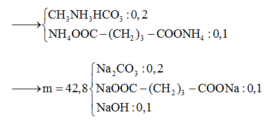
a)
\(RCOOH + C_2H_5OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons RCOOC_2H_5 + H_2O\)
n C2H5OH = 0,7 < n A = 0,8 nên hiệu suất tính theo số mol C2H5OH
$RCOOH + NaOH \to RCOONa + H_2O$
n RCOOH dư = n NaOH = 0,2.2 = 0,4(mol)
=> n C2H5OH pư = n RCOOH pư = 0,8 - 0,4 = 0,4(mol)
Suy ra : H = 0,4/0,7 .100% = 57,14%
b)
n RCOOC2H5 = n C2H5OH pư = 0,4(mol)
Vậy muối khan gồm có :
n RCOONa = n RCOOH dư = 0,4(mol)
=> M RCOONa = R + 67 = 38,4/0,4 = 96
=> R = 29(-C2H5)
Vậy este là C2H5COOC2H5( 0,4 mol)
m este = 0,4.102 = 40,8(gam)