Cho 10,7 gam sắt hiđroxit ( chưa biết hóa trị của sắt) tác dụng vừa đủ với dung dịch HCl thu được 16,25 gam muối. Xác định CTHH của sắt hiđroxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi số mol sắt là x
gọi số mol oxi là y
56x + 16y = 8 (g)..................................(1)
nH = nCl = nHCl = nO .2 = 2y (mol)
mmuối = mFe + mCl = 56x + 35,5.2y = 56x + 71y = 16,25(g).......(2)
từ (1) và (2)=> x=0,1.................................. y=0,15
=> n HCl = 2.0,15 = 0,3 (mol)
=> CM = 0,3/0,5 = 0,6M => a=0,6
\(n_{HCl}=0.5a\left(mol\right)\)
\(BảotoànH:\)
\(n_{H_2O}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.5a=0.25a\left(mol\right)\)
\(BTKL:\)
\(m_{oxit}+m_{HCl}=m_{Muối}+m_{H_2O}\)
\(\Leftrightarrow8+0.5a\cdot36.5=16.25+0.25a\cdot18\)
\(\Rightarrow a=0.6\)
Chúc em học tốt !!!

\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
______0,05------>0,15--------->0,05
=> mH2SO4 = 0,15.98 = 14,7(g)
=> \(C\%\left(H_2SO_4\right)=\dfrac{14,7}{100}.100\%=14,7\%\)
\(C\%\left(Fe_2\left(SO_4\right)_3\right)=\dfrac{0,05.400}{8+100}.100\%=18,52\%\)
PTHH: Fe2(SO4)3 + 6NaOH --> 2Fe(OH)3\(\downarrow\) + 3Na2SO4
________0,05----------------------->0,1
=> mFe(OH)3 = 0,1.107=10,7(g)

a)\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH2O\)
Ta có: \(n_{FeCl_{\dfrac{2y}{x}}}=xn_{Fe_xO_y}=0,1x\left(mol\right)\)
\(\Rightarrow M_{FeCl_{\dfrac{2y}{x}}}=\dfrac{32,5}{0,1x}\)
| x | 1 | 2 | 3 |
| \(M_{FeCl_{\dfrac{2y}{x}}}\) | 325(loại) | 162,5(TM) | 108,33(loại) |
=> Muối có CT: \(FeCl_2\Rightarrow\)CT oxit là FeO
\(FeO+2HCl\rightarrow FeCl_2+H2O\)
0,1---->0,2(mol)
\(\Rightarrow V_{HCl}=\dfrac{0,2}{2}=0,1\left(l\right)\)
b) \(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H2O\)
0,1<---------------0,2
\(\Rightarrow m_{Ba\left(OH\right)2}=0,1.171=17,1\left(g\right)\)
\(\Rightarrow m_{dd}=\dfrac{17,1.100}{17,1}=100\left(g\right)\)
Chúc bạn học tốt ^^

Câu 3:
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right);n_{HCl}=0,1.1=0,1\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Vì:\dfrac{0,1}{1}>\dfrac{0,1}{2}\Rightarrow Fe.dư\\ n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\)
Câu 1:
\(Đặt:FeCl_x\) (x: nguyên dương, x hoá trị của Fe)
\(FeCl_x+xAgNO_3\rightarrow xAgCl\downarrow+Fe\left(NO_3\right)_x\\ n_{AgCl}=\dfrac{8,61}{143,5}=0,06\left(mol\right)\\ n_{FeCl_x}=\dfrac{0,06}{x}\left(mol\right)\\ M_{FeCl_x}=\dfrac{3,25}{\dfrac{0,06}{x}}=\dfrac{3,25x}{0,06}\left(\dfrac{g}{mol}\right)\)
Xét x=1;x=2;x=3;x=4, ta thấy có lúc x=3 thì\(M_{FeCl_3}=162,5\left(\dfrac{g}{mol}\right)\)
Vậy nhận x=3 => CTHH FeCl3

Theo ĐLBTKL:
\(m_{Fe_2\left(SO_4\right)_3}+m_{NaOH}=m_{Fe\left(OH\right)_3}+m_{Na_2SO_4}\)
=> \(m_{NaOH}=10,7+21,3-20=12\left(g\right)=>n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right)\)
=> D

a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$
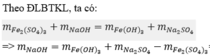
\(Fe\left(OH\right)_n+nHCl\rightarrow FeCl_n+nH_2O\)
Ta có: \(n_{Fe\left(OH\right)_n}=\dfrac{10,7}{56+17n}\left(mol\right)\)
\(n_{FeCl_n}=\dfrac{16,25}{56+35,5n}\left(mol\right)\)
Theo PT: \(n_{Fe\left(OH\right)_n}=n_{FeCl_n}\)
\(\Rightarrow\dfrac{10,7}{56+17n}=\dfrac{16,25}{56+35,5n}\)
\(\Rightarrow n=3\)
Vậy: CTHH cần tìm là Fe(OH)3
FeCl+ H2