Cho dung dịch có chứa 12 gam NaOH phản ứng với dung dịch chứa 29,4 gam H2SO4. Sau phản ứng thu được dung dịch X. Thử giấy quỳ tím với dung dịch X thấy giấy quỳ tím chuyển sang màu
A. Đỏ. B. Xanh. C. Tím. D. Vàng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Phân tử khối của HCl nhỏ hơn của NaOH
=> phản ứng theo tỉ lệ mol 1 : 1 => HCl dư => Quỳ tím chuyển màu sang màu đỏ.

Dung dịch sau phản ứng có chứa NaOH hay HNO 3 dư sẽ quyết định màu của quỳ tím.
- Số mol các chất đã dùng :
n NaOH = 10/40 mol; n HNO 3 = 10/63 mol
- Số mol NaOH nhiều hơn số mol HNO 3 . Theo phương trình hoá học, ta thấy khi phản ứng kết thúc, trong dung dịch còn dư NaOH. Do vậy, dung dịch sau phản ứng làm cho quỳ màu tím chuyển thành màu xanh.

B đúng.
nHBr = 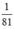 mol
mol
nNaOH = 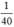 mol
mol
NaOH + HBr → NaBr + H2O
nNaOH > nHBr (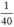 >
> 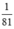 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh

MHBr > MNaOH → nHBr < nNaOH nên dung dịch dư NaOH, nhúng giấy quỳ tím vào thì quỳ tím chuyển sang màu xanh.

H C l + N a O H → N a C l + H 2 O
0,0273 0,025 (mol)
Dung dịch sau phản ứng có HCl dư làm quỳ tím chuyển sang màu đỏ.
Chọn đáp án A.

Chọn đáp án B
n H B r = a 81 < n N a O H = a 40 => NaOH dư => Giấy quỳ chuyển màu xanh.

Chọn B.
X có công thức cấu tạo là C2H4(NH3NO3)2
Chất rắn thu được gồm NaNO3 (0,2 mol) và NaOH dư (0,05 mol)
Þ a = 19
\(n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right);n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\ PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ Vì:\dfrac{0,3}{2}< \dfrac{0,3}{1}\Rightarrow H_2SO_4dư\)
=> Quỳ tím hoá đỏ
=> CHỌN A