Hòa tan hoàn tàn CuO với 200 gam dung dịch H2SO4 19,6% thu được dung dịch A. Cho toàn bộ lượng A phản ứng với dung dịch NaOH thu được 29,4 gam kết tủa và dung dịch B. Tính nồng độ phần trăm chất tan có trong dung dịch B
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\)
\(n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Dung dịch A gồm: CuSO4 và H2SO4 dư
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Đề có cho dữ kiện gì liên quan đến dd NaOH không bạn nhỉ?

a/
\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,15 0,3 (mol)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
\(m_A=90,7+9,3=100\left(g\right)\)
\(C\%_{NaOH}=\dfrac{12}{100}.100\%=12\%\)
b/
m\(_{FeSO_4}=\dfrac{16.200}{100}=32\left(g\right)\)
\(\rightarrow m_{FeSO_4}=\dfrac{32}{152}=\dfrac{4}{19}\left(mol\right)\)
\(2NaOH+FeSO_4\rightarrow Na_2SO_4+Fe\left(OH\right)_2\downarrow\)
bđ: 0,3 \(\dfrac{4}{19}\) 0 0 (mol)
pư: 0,3 0,15 0,15 0,15 (mol)
dư: 0 \(\dfrac{23}{380}\) (mol)
\(m_{Fe\left(OH\right)_2}=0,15.90=13,5\left(g\right)\)
\(m_C=100+200-13,5=286,5\left(g\right)\)
\(m_{Na_2SO_4}=0,15.142=21,3\left(g\right)\)
\(\rightarrow C\%_{Na_2SO_4}=\dfrac{21,3}{286,5}.100\%\approx7,4\%\)
\(m_{FeSO_4\left(dư\right)}=\dfrac{23}{380}.152=9,2\left(g\right)\)
\(\rightarrow C\%_{FeSO_4\left(dư\right)}=\dfrac{9,2}{286,5}.100\%\approx3,2\%\)

Đặt khối lượng kim loại trong hỗn hợp ban đầu là m gam; số mol O trong hoonx hợp ban đầu là a mol; số mol H2SO4 là b mol.
![]()
Sơ đồ phản ứng:
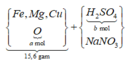
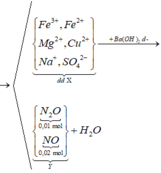
![]()
![]()
Các quá trình tham gia phản ứng của H+: 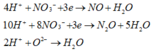
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
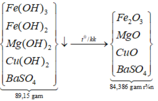
*Xét giai đoạn nung kết tủa đến khối lượng không đổi:
Sơ đồ phản ứng:
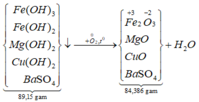
![]()
![]()
![]()
![]()
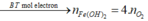
![]()
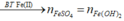
![]()
![]()
![]()
![]() = 85%.
= 85%.
Đáp án A.

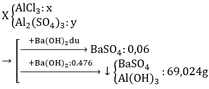
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952


a) \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(n_{HCl}=\dfrac{146.5\%}{36,5}=0,2\left(mol\right)\)
PTHH: CuO + 2HCl --> CuCl2 + H2O
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,2}{2}\) => CuO hết, HCl dư
=> dd sau phản ứng chứa CuCl2, HCl dư
b)
PTHH: CuO + 2HCl --> CuCl2 + H2O
0,05-->0,1------>0,05
mdd sau pư = 4 + 146 = 150 (g)
\(\left\{{}\begin{matrix}C\%_{CuCl_2}=\dfrac{0,05.135}{150}.100\%=4,5\%\\C\%_{HCldư}=\dfrac{\left(0,2-0,1\right).36,5}{150}.100\%=2,433\%\end{matrix}\right.\)
b)
PTHH: NaOH + HCl --> NaCl + H2O
CuCl2 + 2NaOH --> 2NaCl + Cu(OH)2
0,05--------------------------->0,05
Cu(OH)2 --to--> CuO + H2O
0,05----------->0,05
=> \(a=m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
=> \(b=m_{CuO}=0,05.80=4\left(g\right)\)
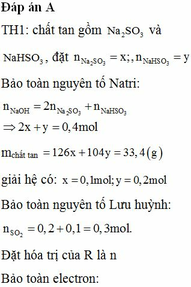


\(n_{H_2SO_4}=\dfrac{200.19,6}{100.98}=0,4mol\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4\left(A\right)}=n_{CuO}=n_{H_2SO_4}=0,4mol\\ n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\\\Rightarrow\dfrac{0,4}{1}>\dfrac{0,3}{1}\Rightarrow CuSO_4.pư.không.hết\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,3mol 0,6mol 0,3mol
\(m_{ddB}=0,4.80+200+0,6.40-29,4=226,6g\\ C_{\%Na_2SO_4\left(B\right)}=\dfrac{0,3.142}{226,6}\cdot100=18,8\%\)
hình như bạn bị sai rồi đó