cho m1 gam Fe tác dụng vừa đủ với m2 gam dung dịch HCl 7,3% .Sau phản ứng thu được 5,6 lít khí H2 ở đktc. Xác định m1 và m2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,04\left(mol\right)\Rightarrow m_1=m_{Zn}=0,04.65=2,6\left(g\right)\)
\(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\Rightarrow m_{HCl}=0,08.36,5=2,92\left(g\right)\)
\(\Rightarrow m_2=m_{ddHCl}=\dfrac{2,92}{14,6\%}=20\left(g\right)\)
b, Ta có: m dd sau pư = mZn + m dd HCl - mH2 = 22,52 (g)
\(n_{ZnCl_2}=n_{H_2}=0,04\left(mol\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{0,04.136}{22,52}.100\%\approx24,16\%\)

Đáp án C
Do X tác dụng với HCl sinh ra khí nên Al dư, CuSO4 và AgNO3 hết
nAl dư=nH2/1,5=0,02 mol
nCu=nCuSO4=0,03 mol
nAg=nAgNO3=0,03 mol
BT e: 3nAl pư=2nCu+nAg=> nAg pư=(0,03.2+0,03)/3=0,03 mol
m1=(0,03+0,02).27=1,35 gam
m2=0,03.64+0,03.108+0,02.27=5,7 gam

Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A

Đáp án A
Vì Al(OH)3 là 1 hyđroxit lưỡng tính
⇒ có thể tác dụng với axit và bazo.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
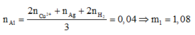
![]()

Chọn đáp án A
Chất rắn X có thể có Al, Cu và chắc chắn có Ag.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
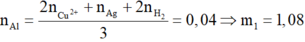
![]()
⇒ Chọn A



Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{Fe}=n_{H_2}=0,25\left(mol\right)\Rightarrow m_{Fe}=0,25.56=14\left(g\right)=m_1\)
\(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{18,25}{7,3\%}=250\left(g\right)=m_2\)