Hòa tan 19,5 gam kẽm (Zn) vào 200 gam dung dịch HCl 14,6% sau phản ứng thu được dùng
dịch có chứa một muối và khí hiđro thoát ra.. a) Tinh thể tích khí hidro sinh ra ở đktc
b) Tính khối lượng muối tạo thành
c) Tính nồng độ phần trăm (C%) của các chất trong dung dịch thu được sau phản ứng.

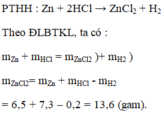
a, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(m_{HCl}=200.14,6\%=29,2\left(g\right)\Rightarrow n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,3}{1}< \dfrac{0,8}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{ZnCl_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow m_{ZnCl_2}=0,3.136=40,8\left(g\right)\)
c, \(n_{HCl\left(pư\right)}=2n_{Zn}=0,6\left(mol\right)\Rightarrow n_{HCl\left(dư\right)}=0,2\left(mol\right)\)
Ta có: m dd sau pư = 19,5 + 200 - 0,3.2 = 218,9 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2.36,5}{218,9}.100\%\approx3,33\%\\C\%_{ZnCl_2}=\dfrac{40,8}{218,9}.100\%\approx18,64\%\end{matrix}\right.\)
\(a)n_{Zn}=\dfrac{19,5}{65}=0,3mol\\ n_{HCl}=\dfrac{200.14,6}{100.36,5}=0,8mol\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow\dfrac{0,3}{1}< \dfrac{0,8}{2}\Rightarrow HCl.dư\\ n_{H_2}=n_{ZnCl_2}=n_{Zn}=0,3mol\\ V_{H_2}=0,3.22,4=6,72l\\ b)m_{ZnCl_2}=0,3.136=40,8g\\ c)n_{HCl.pư}=0,3.2=0,6mol\\ C_{\%ZnCl_2}=\dfrac{40,8}{200+19,5-0,3.2}\cdot100=18,64\%\\ C_{\%HCl.dư}=\dfrac{\left(0,8-0,6\right).36,5}{200+19,5-0,3.2}\cdot100=3,33\%\)