1. Tính số mol của các chất sau
112 ml NO2 ; 224 ml CO2 ; 336 ml N2O ; 672 ml Cl2 ; 8,96 L O2 ; 115 ml SO2 ; 225 ml H2S
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
\(a.\)
\(V_{hh}=\left(0.1+0.2+0.02+0.03\right)\cdot24=8.4\left(l\right)\)
\(b.\)
\(V_{hh}=\left(0.04+0.015+0.06+0.08\right)\cdot24=4.68\left(l\right)\)
\(2.\)
\(a.\)
\(V_{H_2}=0.5\cdot22.4=11.2\left(l\right)\)
\(V_{O_2}=0.8\cdot22.4=17.92\left(l\right)\)
\(b.\)
\(V_{CO_2}=2\cdot22.4=44.8\left(l\right)\)
\(V_{CH_4}=3\cdot22.4=67.2\left(l\right)\)
\(c.\)
\(V_{N_2}=0.9\cdot22.4=20.16\left(l\right)\)
\(V_{H_2}=1.5\cdot22.4=33.6\left(l\right)\)

Bài 1:
\(n_{KNO_3}=\dfrac{20}{101}=0,198\left(mol\right)\)
\(C_M=\dfrac{n}{V}=\dfrac{0,198}{0,85}=0,233M\)
Bài 2:
\(C_M=\dfrac{n}{V}=\dfrac{0,5}{0,75}=0,66M\)
Bài 3:
\(n_{KNO_3}=2.0,5=1\left(mol\right)\)
\(m_{KNO_3}=1.101=101\left(g\right)\)
Bài 4:
\(C\%=\dfrac{20}{600}.100=3,33\%\)
Bài 1:
\(n_{KNO_3}=\dfrac{20}{101}=0,198\left(mol\right)\)
\(C_{M_{ddKNO_3}}=\dfrac{0,198}{0,85}\approx0,23M\)
Bài 2:
\(C_{M_{ddKCl}}=\dfrac{0,5}{0,75}\approx0,667M\)
Bài 3:
\(n_{KNO_3}=0,5.2=1\left(mol\right)\Rightarrow m_{KNO_3}=1.101=101\left(g\right)\)
Bài 4:
\(C\%_{ddKCl}=\dfrac{20.100\%}{600}=3,333\%\)

`#3107.101107`
`a)`
\(2\text{Mg}\left(\text{NO}_3\right)_2\rightarrow2\text{MgO}+4\text{NO}_2+\text{O}_2\)
`b)`
n của \(\text{Mg}\left(\text{NO}_3\right)_2\) trong phản ứng là:
\(\text{n}_{\text{Mg}\left(\text{NO}_3\right)_2}=\dfrac{\text{m}}{\text{M}}=\dfrac{14,8}{24+\left(14+16\cdot3\right)\cdot2}=\dfrac{14,8}{148}=0,1\left(\text{mol}\right)\)
Theo PT: 2 : 2 : 4 : 1 (mol)
`=>`\(\text{n}_{\text{Mg}\left(\text{NO}_3\right)_2}=\text{n}_{\text{MgO}}=2\text{n}_{\text{NO}_2}=\dfrac{1}{2}\text{n}_{\text{O}_2}\)
`=>` \(\text{n}_{\text{NO}_2}=\dfrac{0,1}{2}=0,05\left(\text{mol}\right)\) ; \(\text{n}_{\text{O}_2}=0,1\cdot2=0,2\left(\text{mol}\right).\)

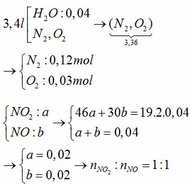
Tỉ lệ mol của 2 khí NO2 và NO là 1:1, khí O2 không đủ nên giả sử mol pứ đều là: x (mol)
2NO2 + ½ O2 + H2O → 2HNO3
x→ 0,25x x
2NO + 1,5O2 + H2O → 2HNO3
x → 0,75x x
pứ: x 2x
nO2 = 0,03 => x = 0,03
=> nHNO3 = 0,06
mbình sau pứ = N2 + mO2 + mH2O+ mNO2 + mNO = 28 . 0,12 + 32 . 0,03 + 40 + 19 . 2 . 0,04 = 45,84g
=> %HNO3 = 8,246%

a) $n_{Fe_2O_3} = \dfrac{24}{160} = 0,15(mol)$
$n_{H_2SO_4} =0,2.2,5 = 0,5(mol)$
b)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Vì :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$n_{H_2SO_4\ pư} = 3n_{Fe_2O_3} = 0,45(mol)$
$n_{H_2SO_4\ dư} = 0,5 - 0,45 = 0,05(mol)$
c)
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,15(mol)$
$C_{M_{Fe_2(SO_4)_3}} = \dfrac{0,15}{0,2} = 0,75M$
$C_{M_{H_2SO_4}} = \dfrac{0,05}{0,2} = 0,25M$

1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
\(n_{NO_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
\(n_{CO_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\)
\(n_{N_2O}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(n_{SO_2}=\dfrac{0,115}{22,4}=\dfrac{23}{4480}\left(mol\right)\)
\(n_{H_2S}=\dfrac{0,225}{22,4}=\dfrac{9}{896}\left(mol\right)\)