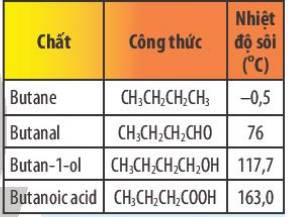
So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau. Giải thích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(M_{benzen}< M_{toulen}< M_{o-xylen}\)
nên nhiệt độ sôi của benzen, toulen, o-xylen tăng dần

a, Nhiệt độ sôi tăng dần theo độ lớn của PTK
b, Ở nhiệt độ phòng, cả 4 chất này đều là chất khí.

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.

a, Gồm 2 cấu hình cis và trans
b, Nhiệt độ sôi thấp nhất và ít tan trong nước nhất là $C_2H_4$ do không tạo được liên kết hidro liên phân tử hay với nước
Còn vì etanol và butanol cùng tạo được liên kết hidro và cùng dãy đồng đẳng nên chất nào có M lớn hơn thì có nhiệt độ sôi lớn hơn => Butanol có nhiệt độ sôi> etanol
Còn về độ tan thì ngược lại etanol dễ tan hơn butanol do etanol tan vô hạn trong nước

Đáp án C
Dựa vào các đ.a thì 3 chất là phenol, glyxin và ancol etylic
Z tan vô hạn trong nước → ancol etylic.
Y phân hủy trước khi sôi → Y là glyxin

Ở nhiệt độ phòng, oxygen nitrogen, cacbon dioxide ở thể khí. Phát biểu nào sau đây đúng?(1 Điểm)
Nhiệt độ sôi của các chất trên cao hơn nhiệt độ phòng.Nhiệt độ sôi của các chất trên thấp hơn nhiệt độ phòng.
Nhiệt độ sôi của các chất bằng nhiệt độ phòng.Không xác định được nhiệt độ sôi của các chất trên.
Nhiệt độ sôi của các chất trên cao hơn nhiệt độ phòng.
Nhiệt độ sôi của các chất trên thấp hơn nhiệt độ phòng.
Nhiệt độ sôi: butanoic acid > butan – 1 – ol > butanal > butane.
Giải thích:
+ Vì Butanoic acid có nhiệt độ sôi cao nhất trong dãy do butanoic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen trong phân tử butan – 1 – ol.
+ Butanal và butane không có liên kết hydrogen nhưng butanal phân cực nên có nhiệt độ sôi cao hơn butane.