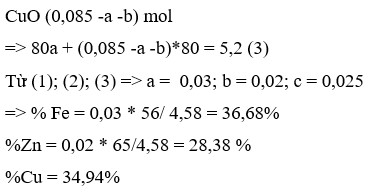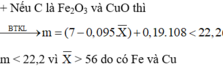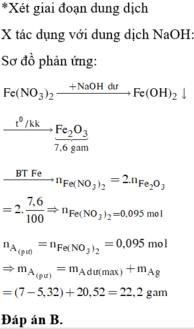cho 6,61 bột a gồm zn fe vào cốc đựng 150 ml dd cu(no3)2 1M. Sau phản ứng thu được dung dịch B và kết tủa C. Thêm dung dịch NaOh dư vào dd B, lọc lấy kết tủa, rửa, nung trong không khí tới khối lượng không đổi thu được 8 g chất rắn D. Các phản ứng xảy ra hoàn toàn. chứng minh rằng cho hỗn hợp A vào dung dịch Cu(No3)2 sau phản ứng còn dư dd cu(no3)2
17:44Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Các phản ứng có thể xảy ra:
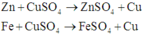
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
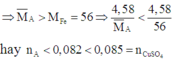
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.
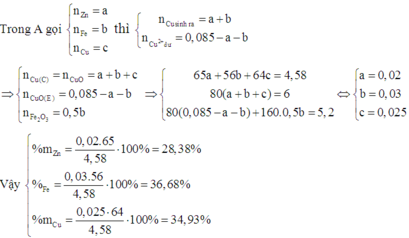

Hỗn hợp 2 KL gồm: Ag và Cu dư.
PT: \(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
\(Zn\left(NO_3\right)_2+2KOH\rightarrow2KNO_3+Zn\left(OH\right)_2\)
\(Cu\left(NO_3\right)_2+2KOH\rightarrow2KNO_3+Cu\left(OH\right)_2\)
\(Zn\left(OH\right)_2+2KOH\rightarrow K_2ZnO_2+2H_2O\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Chất rắn thu được sau pư là CuO.
Ta có: \(n_{AgNO_3}=0,4.1=0,4\left(mol\right)\)
Theo PT: \(n_{Ag}=n_{AgNO_3}=0,4\left(mol\right)\)
Mà: mAg + mCu dư = 49,6 (g)
⇒ mCu (dư) = 49,6 - 0,4.108 = 6,4 (g)
Ta có: 65nZn + 64nCu (pư) = 19,3 - 6,4 (1)
Theo PT: \(n_{AgNO_3}=2n_{Zn}+2n_{Cu\left(pư\right)}=0,4\left(2\right)\)
Từ (1) và (2) ⇒ nZn = nCu (pư) = 0,1 (mol)
Theo PT: \(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{Cu\left(NO_3\right)_2}=n_{Cu\left(pư\right)}=0,1\left(mol\right)\)
⇒ m = mCuO = 0,1.80 = 8 (g)

a) PTHH: \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
a_______a________a_____a (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
b_______b_______b_____b (mol)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
b) Ta có: \(n_{CuSO_4}=0,3\cdot1=0,3\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Fe\left(dư\right)}=24,8-0,3\cdot64=5,6\left(g\right)\) \(\Rightarrow m_{Fe\left(p/ứ\right)}+m_{Mg}=16-5,6=10,4\left(g\right)\)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}24a+56b=10,4\\a+b=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2\cdot24}{16}\cdot100\%=30\%\\\%m_{Fe}=70\%\end{matrix}\right.\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(p/ứ\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,05\cdot160=11\left(g\right)\)