cho a gam Fe vào 500 ml dung dịch hỗn hợp gồm Hcl 1,8M và Cu(NO3)2 0,2M . Sau khi các phản ứng xảy ra hoàn toàn thu được 0,5 gam hỗn hợp kim loại và khí NO( sản phẩm khử duy nhất ). Giá trị của a là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Ta có:
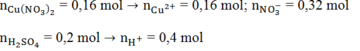
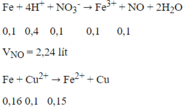
Do Fe nên tiếp tục xảy ra phản ứng:

nFe phản ứng = 0,1 + 0,05 + 0,16 = 0,31 mol
0,6m (g) hỗn hợp bột kim loại sau phản ứng gồm Fe dư và Cu sinh ra:
m - mFe pư + mCu = 0,6m → m - 0,31.56+ 64.0,16 = 0,6m
m = 17,8 (g)

Đáp án A
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol;
số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
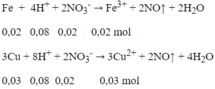
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH-.
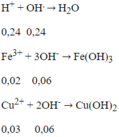
Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol
→ V = 360ml

Đáp án A
Dựa vào bản chất phản ứng của X với NaHCO 3 , bảo toàn nguyên tố O; bảo toàn electron trong phản ứng đốt cháy X, ta có :
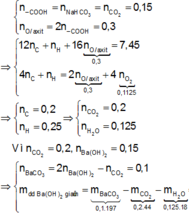
= 8,65 gam

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

Đáp án C
Ta có: n B a C O 3 = 0 , 05 m o l suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b => 232a+80b= 25,4
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N: n N O 3 - t r o n g Y = 1 , 2 - 0 , 175 = 1 , 025 m o l = n N a O H → V = 1 , 025
Ta có 2 TH xảy ra:
TH1: HNO3 dư
a+0,05.2=0,175 =>a=0,075=> b= 0,1 → % F e 3 O 4 = 68 , 5 %
TH2: HNO3 hết
8a+2b-0,05.2+0,175.3= 1,025 nghiệm âm loại.






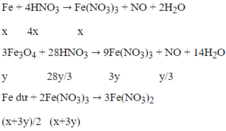
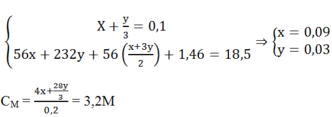
\(n_{Cu\left(NO_3\right)_2}=0,5.0,2=0,1\left(mol\right)\)
\(n_{NO_3^-}=0,1.2=0,2\left(mol\right)\)
\(n_{Cu^{2+}}=0,1\left(mol\right)\)
\(n_{HCl}=n_{H^+}=0,5.1,8=0,9\left(mol\right)\)
\(n_{NO}=\dfrac{n_{H^+}}{4}=\dfrac{0,9}{4}=0,225\left(mol\right)\)
Sau phản ứng thu được hỗn hợp kim loại \(\Rightarrow\) Cu và Fe \(\Rightarrow\) \(Fe^{2+}\)
Bảo toàn e:
\(2n_{Fe.pứ}=3n_{NO}+2n_{Cu^{2+}}\)
\(\Rightarrow n_{Fe.pứ}=0,4375\left(mol\right)\)
Có: \(a-m_{Fe.pứ}+m_{Cu}=m_{hh.kl}=0,5\)
\(\Leftrightarrow a-0,4375.56+64.0,1=0,5\\ \Rightarrow a=18,6\)