Cho hỗn hợp X gồm m(g) Fe và 30,16g Fe3O4 tác dụng với H2SO4 loãng dư được dung dịch gồm FeSO4 và Fe2(SO4)3 và khí H2. Cho tác dụng với 90ml KMNO4 0,57M vừa đủ. Tính phần trăm về khối lượng của Fe trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=19.3\left(g\right)\left(1\right)\)
\(n_{H^+}=0.2\cdot2+0.2\cdot2.25\cdot2=1.3\left(mol\right)\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(Fe+2H^+\rightarrow Fe^{2+}+H_2\)
\(n_{H^+}=3a+2b=1.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.2\)
\(\%Al=\dfrac{0.3\cdot27}{19.3}\cdot100\%=41.96\%\)
\(\%Fe=58.04\%\)
\(b.\)
\(n_{H_2}=\dfrac{1}{2}n_{H^+}=0.65\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=19.3+0.4\cdot36.5+0.45\cdot98-0.65\cdot2=76.7\left(g\right)\)

a) PTHH: \(Ca+H_2SO_4\rightarrow CaSO_4+H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
b) Ta có: \(\Sigma n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo các PTHH, ta thấy \(n_{H_2SO_4}=n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,5\cdot98=49\left(g\right)\)
Mặt khác: \(m_{H_2}=0,5\cdot2=1\left(g\right)\)
Bảo toàn khối lượng: \(m_{hh}=m_{muối}+m_{H_2}-m_{H_2SO_4}=68+1-49=20\left(g\right)\)

Gọi x, y lần lượt là số mol Al, Fe
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}27x+56y=0,83\\1,5x+y=0,025\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,01\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Al}=0,27\left(g\right)\\m_{Fe}=0,56\left(g\right)\end{matrix}\right.\)

Đáp án B
Dùng phương pháp đường chéo tính được mol CO2 là 0,2 mol và H2 là 0,15 mol.
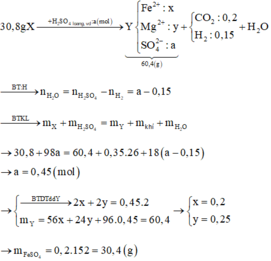

Đáp án C
Trong X, chỉ có Fe tác dụng với dung dịch H2SO4 loãng:


Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Fe_3O_4}=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần)
- Phần 1: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\)
Theo PT: \(n_{H_2SO_4}=n_{Fe}+4n_{Fe_3O_4}=x+4y=0,09.1=0,09\left(mol\right)\left(1\right)\)
- Phần 2: \(n_{SO_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
BT e, có: 3nFe + nFe3O4 = 2nSO2 ⇒ 3x + y = 0,025.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,01\left(mol\right)\\y=0,02\left(mol\right)\end{matrix}\right.\)
→ X gồm: 0,02 (mol) Fe và 0,04 (mol) Fe3O4.
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,02.56=1,12\left(g\right)\\m_{Fe_3O_4}=0,04.232=9,28\left(g\right)\end{matrix}\right.\)