Câu 10 : Hòa tan hoàn toàn 7,68 gam kim loại R (hóa trị II) bằng dung dịch axit sunfuric loãng lấy dư. Sau phản ứng thu được 7,168 lít H2(đktc). Cho biết tên, KHHH của kim loại M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.

nH2 = 0,3 mol
2A + nH2SO4 → A2(SO4)n + nH2
0,6/n ← 0,3 mol
mA = 2,8 gam, nA = 0,6/n
→ MA = 2,8.n/0,6 = 14n/3, xét các giá trị n = 1, 2, 3 để suy ra MA
Với đề bài này thì không ra được đáp án nhé.

Chọn B
Kim loại hóa trị II Þ nM = nH2 = 0,6 Þ MM = 14,4/0,6 = 24 (Mg).

\(n_R=\dfrac{13}{M_R}\left(mol\right)\)
PTHH: R + H2SO4 --> RSO4 + H2
____\(\dfrac{13}{M_R}\)------------->\(\dfrac{13}{M_R}\)-->\(\dfrac{13}{M_R}\)
=> \(\dfrac{13}{M_R}\left(M_R+96\right)=32,2\)
=> MR = 65(g/mol)
=> R là Zn
\(n_{H_2}=\dfrac{13}{65}=0,2\left(mol\right)\)
=> VH2 = 0,2.22,4 = 4,48(l)
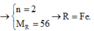
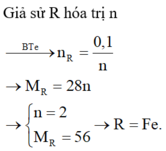
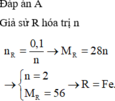
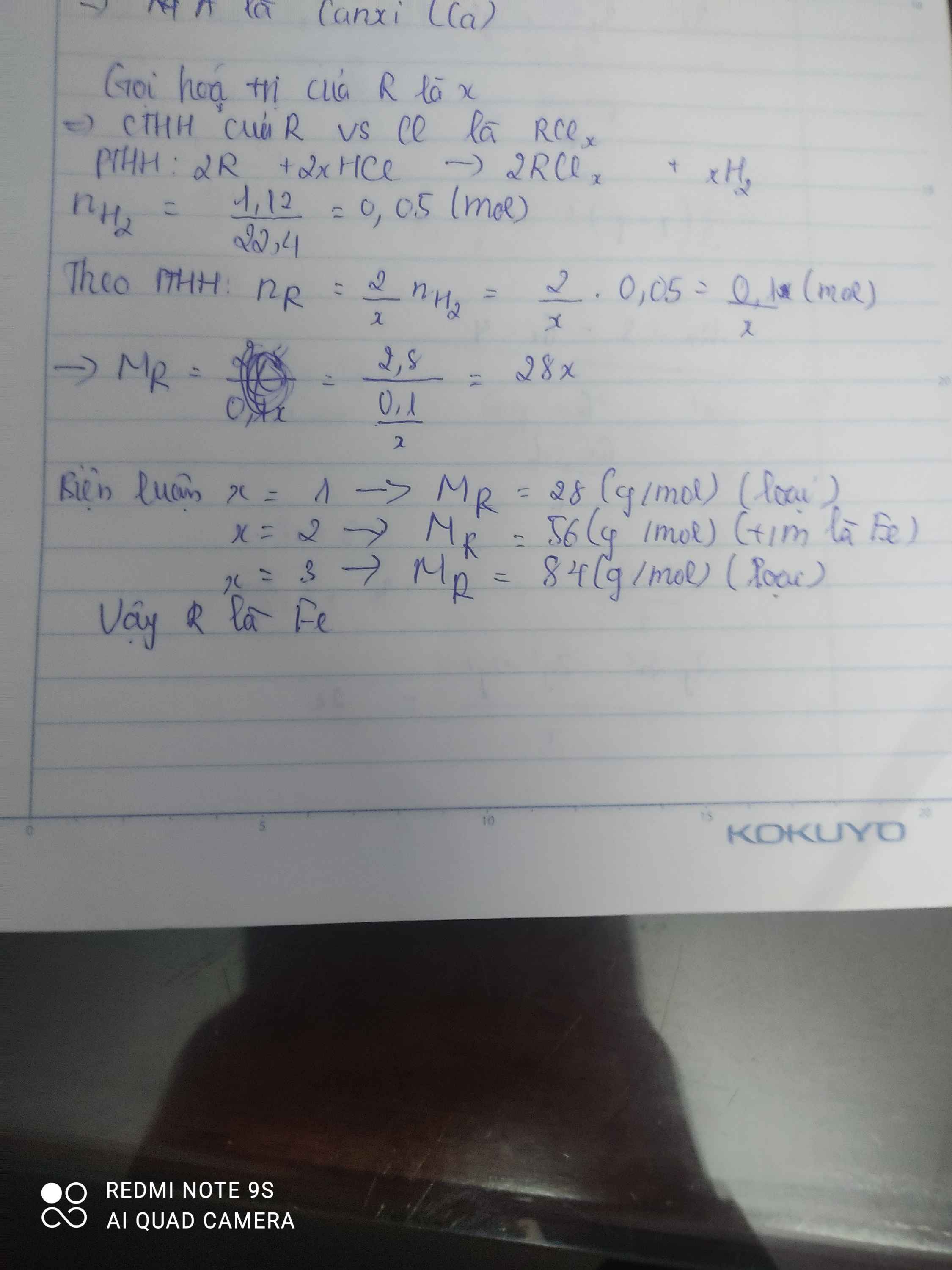
\(R+H_2SO_4\rightarrow RSO_4+H_2\\ n_{H_2}=\dfrac{7,168}{22,4}=0,32\left(mol\right)\\ n_R=n_{H_2}=0,32\left(mol\right)\\ M_R=\dfrac{7,68}{0,32}=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow R\left(II\right):Magie\left(Mg=24\right)\)