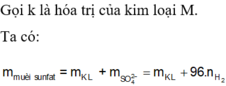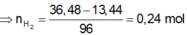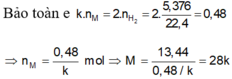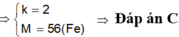Hoà tan hoàn toàn m gam kim loại Fe bằng dung dịch H2SO4 loãng 10% vừa đủ thu được dung dịch A. Làm lạnh dung dịch A tách được 27,8 gam muối sunfat kết tinh ngậm nước và còn lại dung dịch muối sunfat bão hoà có nồng độ 10,765%. Tìm công thức muối sunfat ngậm nước. Huhu giúp mình với, mình đã tham khảo nhiều nguồn trên mạng nhưng vẫn không biết cách giải🥺
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) 2M + 2nHCl --> 2MCln + nH2 (1)
nM=\(\dfrac{16,8}{M_M}\)(mol)
nH2=0,3(mol)
theo (1) : nM=\(\dfrac{2}{n}\)nH2=\(\dfrac{0,6}{n}\)(mol)
=>\(\dfrac{16,8}{M_M}=\dfrac{0,6}{n}=>M_M=28n\)(g/mol)
Xét thì chỉ có n=2 là phù hợp => MM=56(g/mol)
=>M:Fe
b) Fe+ H2SO4 --> FeSO4 + H2(2)
nFe=0,45(mol)
Theo (2) : nH2SO4=nFeSO4=nH2=0,45(mol)
=> mddH2SO4=\(\dfrac{0,45.98.100}{10}=441\left(g\right)\)
=> mFeSO4=68,4(g)
=> mdd sau pư= 25,2+441 - 0,45.2=465,3(g)
=> C%ddFeSO4= \(\dfrac{68,4}{465,3}.100=14,7\left(\%\right)\)
Gỉa sử muối sunfat kết tinh ngậm nước là FeSO4.nH2O
mdd sau pư còn lại sau khi muối kết tinh ngậm nước tách ra là :
465,3 - 55,6=409,7(g)
=> mFeSO4(còn lại )=\(\dfrac{409,7.9,275}{100}\approx38\left(g\right)\)
=> nFeSO4(còn lại) = 0,25(mol)
=> nFeSO4.nH2O=nFeSO4(còn lại)=0,25(mol)
=> 0,25.(152+18n)=55,6=> n\(\approx\)4
=> CT muối kết tinh là : FeSO4.4H2O

a)
\(n_{O_2\left(pư\right)}=\dfrac{16,6-15}{32}=0,05\left(mol\right)\)
Bảo toàn O: nH2O = 0,1 (mol)
Bảo toàn H: nH2SO4 = 0,1 (mol)
=> \(V_{dd.H_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b)
Theo ĐLBTKL: moxit + mH2SO4 = mmuối + mH2O
=> 16,6 + 0,1.98 = mmuối + 0,1.18
=> mmuối = 24,6 (g)

Bạn xem lời giải ở đây nhé.
https://hoc24.vn/cau-hoi/hoa-tan-108-g-mg-vao-dd-h2so4-20-vua-du-sau-khi-phan-ung-ket-thuc-thu-duoc-dd-x-lam-lanh-dd-x-xuong-20-do-c-thu-duoc-1476-g-muoi-sunfat-ket-ti.4797186776937

\(m_{SO_4}=m_{muối.sunfat}-m_{kim.loai}=79,44-19,92=59,52\left(g\right)\)
=> \(n_{SO_4}=\dfrac{59,52}{96}=0,62\left(mol\right)\)
=> \(n_{H_2SO_4\left(pư\right)}=0,62\left(mol\right)\)
\(n_{O_2\left(pư\right)}=\dfrac{25,04-19,92}{32}=0,16\left(mol\right)\)
Bảo toàn O: \(n_{H_2O}=0,32\left(mol\right)\)
Bảo toàn H: \(n_{H_2}=\dfrac{0,62.2-0,32.2}{2}=0,3\left(mol\right)\)
=> V = 0,3.22,4 = 6,72 (l)