cho 23 gam rượu etylic tác dụng với 120gam axitaxetic. tính khối lượng etylaxetat tạo thành. biết hiệu xuất phản ứng là 90%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nC2H5OH = 46/46 = 1 (mol)
PTHH: 2C2H5OH + 2Na -> 2C2H5ONa + H2
nC2H5ONa (LT) = 1 (mol)
nC2H5ONa (TT) = 1 . 75% = 0,75 (mol)
mC2H5ONa = 0,75 . 68 = 51 (g)

Bài 1:
PTHH: \(C_2H_5OH+O_2\xrightarrow[]{mengiấm}CH_3COOH+H_2O\)
Ta có: \(n_{C_2H_5OH}=\dfrac{115\cdot0,8}{46}=2\left(mol\right)=n_{CH_3COOH\left(lýthuyết\right)}\)
\(\Rightarrow m_{CH_3COOH\left(thực\right)}=2\cdot60\cdot90\%=108\left(g\right)\)
Bài 2:
PTHH: \(C_2H_5OH+CH_3COOH\xrightarrow[H_2SO_4\left(đ\right)]{t^o}CH_3COOC_2H_5+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CH_3COOH}=\dfrac{60}{60}=1\left(mol\right)\\n_{C_2H_5OH}=\dfrac{92}{46}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Rượu còn dư, Axit p/ứ hết
\(\Rightarrow n_{CH_3COOC_2H_5\left(lýthuyết\right)}=1\left(mol\right)\) \(\Rightarrow m_{CH_3COOC_2H_5\left(thực\right)}=1\cdot88\cdot80\%=70,4\left(g\right)\)

\(n_{CH_3COOH} = \dfrac{60}{60} = 1(mol)\\ n_{C_2H_5OH} = \dfrac{55,2}{46} = 1,2(mol)\\ CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O\\ n_{CH_3COOH} = 1(mol) < n_{C_2H_5OH} =1,2\)
Do đó hiệu suất tính theo số mol của CH3COOH
\(n_{CH_3COOH\ pư} = n_{CH_3COOC_2H_5} = \dfrac{55}{88} = 0,625(mol)\\ H = \dfrac{0,625}{1}.100\% = 62,5\%\)

\(n_{CH_3COOC_2H_5}=\dfrac{4,4}{88}=0,05\left(mol\right)\)
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
0,05<--------------------------------------0,05
=> \(m_{CH_3COOH\left(lý.thuyết\right)}=0,05.60=3\left(g\right)\)
=> \(m_{CH_3COOH\left(tt\right)}=\dfrac{3.100}{60}=5\left(g\right)\)

$PTHH : CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4 đ,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O \\ n_{CH_3COOH} = \dfrac{3}{60} = 0,05(mol) \\ n_{C_2H_5OH} = \dfrac{2,5}{46} = 0,054(mol) \\ Ta có : n_{C_2H_5OH} > n_{CH_3COOH} \to C_2H_5OH dư \\ n_{ CH_3COOC_2H_5 } = n_{CH_3COOH} = 0,05(mol) \\ m_{este} = 0,05.88 = 4,4(gam) \\ m_{este(tt)} = 4,4.0,9 = 3,96(gam)$

Phương trình hoá học của phản ứng giữa CH 3 COOH và C 2 H 5 OH :
![]()
Số mol CH 3 COOH = 30/60 = 0,5 mol
Số mol C 2 H 5 OH = 92/46 = 2 mol
Vậy theo phương trình hoá học, số mol C 2 H 5 H dư.
Giả sử hiệu suất đạt 100% => netyl axetat = naxit axetic = 0,5 mol.
Vì hiệu suất đạt 60% nên số mol etyl axetat thu được là : 0,5 x 60/100 = 0,3 mol
Khối lượng etyl axetat thu được là 0,3 x 88 = 26,4 (gam)

a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{Br_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,035\left(mol\right)\)
\(\Rightarrow m_{C_2H_4}=0,035.28=0,98\left(g\right)\)
\(\Rightarrow m_{CH_4}=3,92-0,98=2,94\left(g\right)\)
b, Có: \(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{2,94}{3,92}.100\%=75\%\\\%m_{C_2H_4}=25\%\end{matrix}\right.\)
c, PT: \(C_2H_4+H_2O\xrightarrow[H^+]{t^o}C_2H_5OH\)
Theo PT: \(n_{C_2H_5OH\left(LT\right)}=n_{C_2H_4}=0,035\left(mol\right)\)
\(\Rightarrow m_{C_2H_5OH\left(LT\right)}=0,035.46=1,61\left(g\right)\)
Mà: \(m_{C_2H_5OH\left(TT\right)}=0,483\left(g\right)\)
\(\Rightarrow H\%=\dfrac{0,483}{1,61}.100\%=30\%\)
Bạn tham khảo nhé!

a)
$C_2H_5OH + CH_3COOH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O$
b)
n CH3COOC2H5 = n C2H5OH = 9,2/46 = 0,2(mol)
=> m este = 0,2.88 = 17,6 gam
c)
n este = 8,8/88 = 0,1(mol)
=> n C2H5OH = n CH3COOH = 0,1/60% = 1/6 mol
=> m C2H5OH = 46 . 1/6 = 7,67(gam) ; m CH3COOH = 60 . 1/6 = 10(gam)
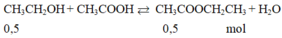
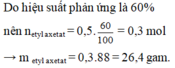
\(CH_3COOH+C_2H_5OHCH_3⇌COOHC_2H_5+H_2O\) ( \(dk:H_2SO_4\left(đặc\right),t^o\))
\(n_{CH_3COOH}=\dfrac{m}{M}=\dfrac{23}{60}\left(mol\right)\)
\(n_{C_2H_5OH}=\dfrac{m}{M}=\dfrac{120}{46}=\dfrac{60}{23}\left(mol\right)\)
\(\dfrac{23}{60}\left(mol\right)< \dfrac{60}{23}\left(mol\right)\Rightarrow\) \(C_2H_5OH\) dư
Cho hiệu suất là \(100\%\Rightarrow n_{COOHC_2H_5}=n_{C_2H_5OH}=\dfrac{60}{23}\left(mol\right)\)
Hiệu suất là \(90\%\Rightarrow n_{COOHC_2H_5}=\dfrac{\dfrac{60}{23}\times90}{100}=\dfrac{54}{23}\left(mol\right)\)
Vậy \(m_{COOHC_2H_5}=n.M=\dfrac{54}{23}.88=\dfrac{4752}{23}\approx207\left(g\right)\)