Chia m gam hỗn hợp hai ancol thành hai phần bằng nhau.
Phần 1: Đốt cháy hoàn toàn, thu được 2,24 lít khí CO2 (đktc).
Phần 2: Đề hiđrat hóa (tách H2O) hoàn toàn thu được hỗn hợp 2 anken. Nếu đốt cháy hết 2 anken thì thu được bao nhiêu gam nước?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Hướng dẫn CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n + H2 → CnH2n + 2
nCO2 = nH2O = 6,3/18 = 0,35 mol
VCO2 = 0,35.22,4 = 7,84 lít

Đáp án B
Khi đốt cháy 15,3 gam Y ta có:
n C O 2 = 0 , 75 ( m o l ) ; n H 2 O = 0 , 75 ( m o l )
=> este no, đơn chức, mạch hở
=> ancol và axit cũng no, đơn chức, mạch hở
Bảo toàn khối lượng ta có:
m e s t e = m C + m H + m O = 12 n C O 2 + 2 n H 2 O + 16 n ( O t r o n g e s t e ) ⇒ n ( O t r o n g e s t e ) = 0 , 3 ( m o l ) ⇒ n e s t e = 0 , 15 ( m o l )
=> este có CTPT là C5H10O2
Xét phần 1 có: n H 2 = 0 , 15 ( m o l ) .
Vì axit và ancol đơn chức ⇒ n a x i t + n a n c o l = 0 , 3 ( m o l )
Xét phần 2: n C O 2 = 0 , 9 ( m o l ) ⇒ C ¯ X = 3
=>trong X một chất có 4 nguyên tử C, một chất có 1 nguyên tử C trong phân tử.
=>Các CTCT phù hợp của Y là:
H C O O C H 2 ( C H 2 ) 2 C H 3 ; H C O O C H 2 ( C H 3 ) C H 2 C H 3 ; H C O O C H 2 ( C H 3 ) ( C H 3 ) - C H 3 ; H C O O C H 2 - C H ( C H 3 ) - C H 3 ; C H 3 ( C H 2 ) 2 C O O C C H 3 ; C H 3 - C H ( C H 3 ) - C O O C C H 3
Chú ý: Bài toán chỉ cho rằng phần 3 thực hiện este hóa thu được este Y chứ không nói rằng khối lượng este trong phần 3 là 15,3 gam. Nếu bạn nào ngộ nhận khối lượng este là 15,3 gam sẽ thấy các số liệu bên trên của phần 1 và phần 2 không thỏa mãn.

Đáp án D
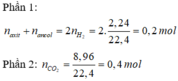
Phần 3:
0,11g este + O 2 → 0,005 mol CO 2 +0,005mol H 2 O
Þ Este no Þ Axit và ancol đều no.
Áp dụng định luật bảo toàn khối lượng có:
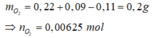
Áp dụng định luật bảo toàn nguyên tố O có: 2neste=2.0,005 + 0,005 – 2.0,00625=0,0025 mol Þ neste= 0,00125 mol
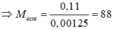
Þ CTPT của este là C4H8O2
Trường hợp 1: Axit là HCOOH (a mol) , ancol là C3H7OH (b mol)
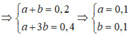
Trường hợp 2: Axit CH3COOH ( a mol), ancol là C2H5OH (b mol)
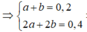
Thỏa mãn với tất cả các giá trị 0 < a, b<0,2
Trường hợp 3: Axit C2H5COOH (a mol), ancol là CH3OH (b mol)
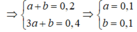
Vậy cả 3 trường hợp đều thỏa mãn.

+ phần 1: nC/ hỗn hợp = nCO2 = 0,1
+ phần 2 : Phản ứng hiđro hóa không làm thay đổi C trong hợp chất
áp dụng định luật bảo toàn nguyên tố C có: nCO2 = nC/ hỗn hợp = 0,1 mol
⇒ V = 2,24l
Đáp án B.

- Đem hiđro hóa hỗn hợp không làm thay đổi thành phần C có trong hỗn hợp.
- Vậy khí CO 2 thu được ở phần 2 bằng lượng khí thu được ở phẩn 1 và bằng 22,4 lít.
- Chọn đáp án B.

Đáp án : C
Gọi ancol là RCH2OH, ta có:
RCH2OH + CuO → RCHO + H2O + Cu
=> Khi phản ứng với Na, ancol ban đầu và hỗn hợp sau phản ứng đều tạo lượng H2 như nhau.
=> n ancol = 2nH2 = 0,5 mol
Đốt phẩn 2: nCO2 = nH2O = 1,5 => Ancol không no, số C = 1 , 5 0 , 5 = 3
=> Ancol là CH2=CH-CH2OH
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BTNT C, có: nCO2 (khi đốt anken) = nCO2 = 0,1 (mol)
⇒ nH2O = nCO2 = 0,1 (mol)
\(\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)