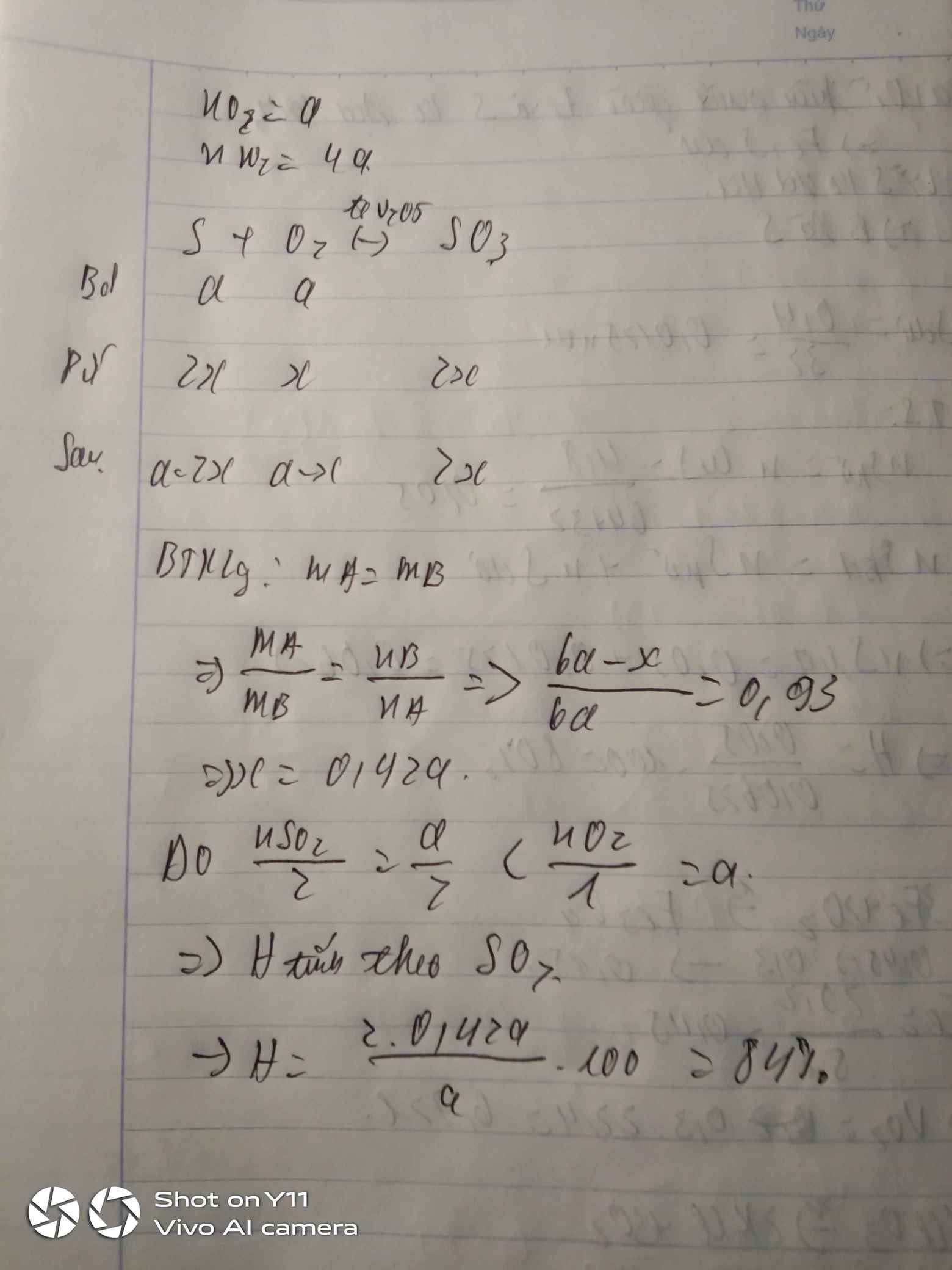Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol là 1/2 đối với khí O2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 2:
a) Vì khối lượng mol của N2 và CO đều bằng 28 và lớn hơn khối lượng mol của khí metan CH4 (28>16)
=> \(d_{\dfrac{hhX}{CH_4}}=\dfrac{28}{16}=1,75\)
Hỗn hợp X nhẹ hơn không khí (28<29)
b)
\(M_{C_2H_4}=M_{N_2}=M_{CO}=28\left(\dfrac{g}{mol}\right)\\ \rightarrow M_{hhY}=28\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{Y}{H_2}}=\dfrac{28}{2}=14\)
c) \(\%V_{NO}=100\%-\left(30\%+30\%\right)=40\%\\ \rightarrow\%n_{CH_4}=40\%\\ Vì:\%m_{CH_4}=22,377\%\\ Nên:\dfrac{30\%.16}{40\%.30+30\%.16+30\%.\left(x.14+16\right)}=22,377\%\\ \Leftrightarrow x=-0,03\)
Sao lại âm ta, để xíu anh xem lại như nào nhé.
Bài 1:
\(a.\\ d_{\dfrac{SO_2}{O_2}}=\dfrac{64}{32}=2\\ d_{\dfrac{SO_2}{N_2}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{SO_3}}=\dfrac{64}{80}=0,8\\ d_{\dfrac{SO_2}{CO}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{N_2O}}=\dfrac{64}{44}=\dfrac{16}{11}\\ d_{\dfrac{SO_2}{NO_2}}=\dfrac{64}{46}=\dfrac{32}{23}\\ b.M_{hhA}=\dfrac{1.64+1.32}{1+1}=48\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hhA}{O_2}}=\dfrac{48}{32}=1,5\)

Gọi: nSO2 = a (mol) ⇒ nO2 = 2a (mol)
\(\Rightarrow M_A=\dfrac{m_{SO_2}+m_{O_2}}{n_{SO_2}+n_{O_2}}=\dfrac{64a+32.2a}{a+2a}=\dfrac{128}{3}\left(g/mol\right)\)
\(\Rightarrow d_{A/O_2}=\dfrac{\dfrac{128}{3}}{32}=\dfrac{4}{3}\)

\(M_{hh}=\dfrac{M_{SO_2}.1+M_{O_2}.3}{1+3}=\dfrac{64.1+32.3}{4}=40\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hh}{O_2}}=\dfrac{40}{32}=1,25\)

dX/H2 = 24 => trong hỗn hợp khí X , nSO2 = nO2
Đặt nSO2 = nO2 = a mol
2SO2 + O2 -> 2SO3
Đặt nO2 phản ứng = b mol
Sau phản ứng, hỗn hợp Y gồm a-2b mol SO2 , a-b mol O2 và 2b mol SO3 dY/H2 = 30 <=> 64(a-2b)+32(a-b)+80.2b=2.30.(2a-b) => a=5/2b
Phần trăm số mol của O2 trong hỗn hợp Y là: (a-b)/(2a-b) = 37,5%
Đáp án D

Đặt \(n_{O_2}=x;n_{CO_2}=y\)
\(n_X=\dfrac{4,48}{22,4}=0,2\left(mol\right)\Leftrightarrow x+y=0,2\)
Ta có: \(16x+44y=\left(x+y\right).18.2\)
\(\Leftrightarrow2y=5x\)
\(\Leftrightarrow\dfrac{y}{5}=\dfrac{x}{2}\)
Mà x+y=0,2
\(\Rightarrow\dfrac{y}{5}=\dfrac{x}{2}=\dfrac{x+y}{5+2}=\dfrac{0,2}{7}=0,0286\)
\(\Rightarrow y=5.0,0286=0,143\left(mol\right);x=0,2-0,143=0,057\left(mol\right)\)


Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)

Hỗn hợp đầu có : V = 20 lít, M = 3.16 = 48
Áp dụng phương pháp đường chéo ta có :
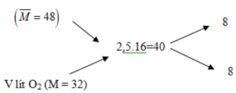
V O 2 = 20 lít

a)
Gọi $n_{CO} = a ; n_{NO} = b$
Ta có :
$28a + 30b = (a + b). $\dfrac{103}{14}.4$
$\Rightarrow \dfrac{10}{7}a = \dfrac{4}{7}b$
$\Rightarrow \dfrac{a}{b} = \dfrac{2}{5}(1)$
b)
$28a + 30b = 20,6(2)$
Từ (1)(2) suy ra a = 0,2 ;b = 0,5
$n_{O_2} = 0,5(mol)$
2CO + O2 \(\xrightarrow{t^o}\) 2CO2
0,2..........0,1............0,2........(mol)
2NO + O2 \(\xrightarrow{t^o}\) 2NO2
0,5.........0,25...........0,5............(mol)
Sau phản ứng, B gồm :
CO2 : 0,2 mol
NO2 : 0,5 mol
O2 dư : 0,5 - 0,25 - 0,1 = 0,15(mol)
$n_{hh} = 0,2 + 0,5 + 0,15 = 0,85\ mol$
$\%n_{CO_2} = \dfrac{0,2}{0,85}.100\% = 23,53\%$
$\%n_{NO_2} = \dfrac{0,5}{0,85} .100\% = 58,82\%$
$\%n_{O_2\ dư} = 17,65\%$
Bảo toàn khối lượng : $m_B = m_A + m_{O_2} = 20,6 + 0,5.32 = 36,6(gam)$
$M_B = \dfrac{36,6}{0,85} = 43,06(g/mol)$
$d_{B/He} = \dfrac{43,06}{4} = 10,765$
a) \(M_A=\dfrac{103}{14}.4=\dfrac{206}{7}\)
Lập sơ đồ đường chéo :
=> \(\dfrac{n_{CO}}{n_{NO}}=\dfrac{30-\dfrac{206}{7}}{\dfrac{206}{7}-28}=\dfrac{2}{5}\)
b)Gọi x, y lần lượt là số mol CO, NO
=> \(\left\{{}\begin{matrix}28x+30y=20,6\\\dfrac{x}{y}=\dfrac{2}{5}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,2\\y=0,5\end{matrix}\right.\)
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
2CO + O2 → 2CO2
0,2---->0,1---->0,2
2NO + O2 → 2NO2
0,5---->0,25--->0,5
=> Hỗn hợp khí B gồm : \(\left\{{}\begin{matrix}O_{2\left(dư\right)}=0,5-\left(0,1+0,25\right)=0,15\left(mol\right)\\n_{CO_2}=0,2\left(mol\right)\\n_{NO_2}=0,5\left(mol\right)\end{matrix}\right.\)
=> \(M_B=\dfrac{0,15.32+0,2.44+0,5.46}{0,15+0,2+0,5}=\dfrac{732}{17}\)
dB/He= \(\dfrac{732}{17}:4=\dfrac{183}{17}\approx10,77\)