Cho m gam hỗn hợp bột gồm Al và Na2CO3 tác dụng với dung dịch HCl dư thu được 8,96 lít (đktc) hỗn hợp khí Y gồm H2 và CO2 có tỉ khối so với H2 bằng 6,25. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải thích:
nAl = 0,29 mol
Đặt số mol N2 và H2 lần lượt là x, y (mol)

BTe: 3nAl = 10nN2 + 2nH2 + 8nNH4+ => 3.0,29 = 10.0,06 + 2.0,015 + 8nNH4+ => nNH4+ = 0,03 mol
BTNT “N”: nNaNO3 = nNH4+ + 2nN2 = 0,03 + 0,06.2 = 0,15 mol
Vậy trong X có chứa các ion:
Al3+: 0,29
NH4+: 0,03
Na+: 0,15
Cl-: 0,29.3 + 0,03 + 0,15 = 1,05
m = 7,83 + 0,03.18 + 0,15.23 + 0,9.35,5 = 49,095 gam
Đáp án D

a) Gọi $n_{CO_2} = a(mol) ; n_{SO_2} = b(mol)$
Ta có :
$a + b = \dfrac{8,96}{22,4} = 0,4(mol)$
$\dfrac{44a + 64b}{a + b} = 27.2$
Suy ra : a = b = 0,2$
$V_{CO_2} = V_{SO_2} = 0,2.22,4 = 4,48(lít)$
b) Theo PTHH : $n_{K_2SO_3} = n_{SO_2} = 0,2(mol)$
$\Rightarrow m_{K_2SO_3} = 0,2.158 = 31,6(gam)$
Gọi $n_{K_2CO_3} = x(mol) ; n_{Na_2CO_3} = y(mol)$
$\Rightarrow 138x + 106y + 31,6 = 56(1)$
$n_{CO_2} = x + y = 0,2(2)$
Từ (1)(2) suy ra : x = y = 0,1
$m_{K_2CO_3} = 0,1.138 = 13,8(gam) ; m_{Na_2CO_3} = 0,1.106 = 10,6(gam)$
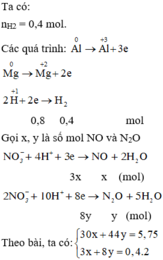

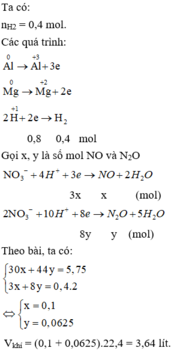

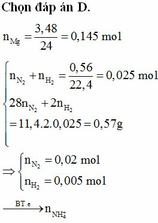

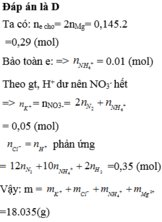

Gọi: \(\left\{{}\begin{matrix}n_{H_2}=x\left(mol\right)\\n_{CO_2}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(1\right)\)
Mà: dY/H2 = 6,25
\(\Rightarrow2x+44y=6,25.2.0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)=n_{H_2}\\y=0,1\left(mol\right)=n_{CO_2}\end{matrix}\right.\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(n_{Na_2CO_3}=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m=m_{Al}+m_{Na_2CO_3}=0,2.27+0,1.106=16\left(g\right)\)