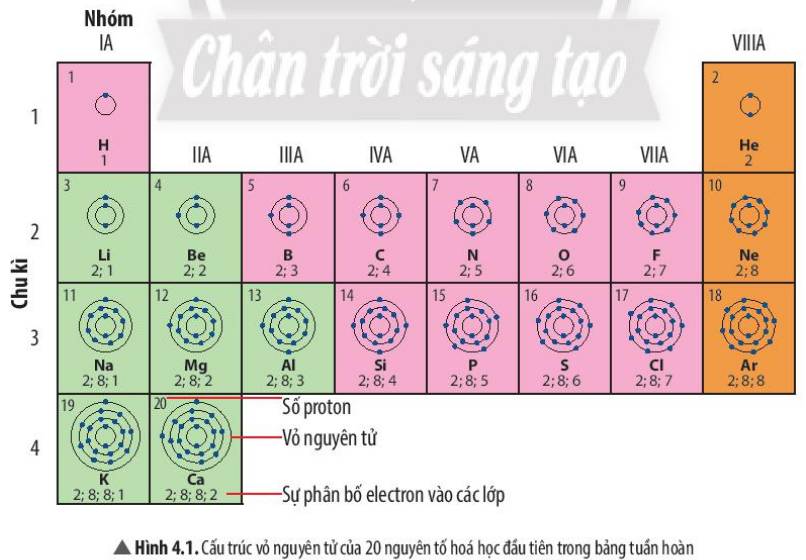
Quan sát Hình 4.1, em hãy cho biết
a) nguyên tử của những nguyên tố nào có cùng số lớp electron
b) nguyên tử của những nguyên tố nào có số electron ở lớp ngoài cùng bằng nhau
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nguyên tử của nguyên tố Beri và Magie có cùng số electron lớp ngoài cùng (2 electron lớp ngoài cùng).

Nguyên tử những nguyên tố natri, liti cùng có số electron ùn có electron lớp ngoài cùng (1 electron).
Nguyên tử của các nguyên tố clo và flo cùng có 7 electron lớp ngoài cùng. Nguyên tử các nguyên tố lưu huỳnh và oxi đều có 6e lớp ngoài cùng.

Nguyên tử của nguyên tố Beri và Bo có cùng số lớp electron (2 lớp electron)
Nguyên tử của nguyên tố Magie và Photpho có cùng số lớp eletron (3 lớp electron).

ngoại trừ He, các nguyên tố khí hiếm còn lại đều có số e lớp ngoài cùng là 8

- Xét mô hình cấu tạo của nguyên tử lithium: có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp vỏ ngoài cùng => Thuộc nhóm IA
- Xét mô hình cấu tạo của nguyên tử chlorine: có 7 hình tròn xanh ở vòng tròn ngoài cùng => Có 7 electron ở lớp vỏ ngoài cùng => Thuộc nhóm VIIA

HD:
a) Lấy 2 nguyên tố khí hiếm, ví dụ: 24He (1s2) và 1020Ne (1s22s22p6).
b) Lấy 2 nguyên tố thuộc nhóm IA, ví dụ: 11H (1s1) và 37Li (1s22s1).
c) Lấy 2 nguyên tố thuộc nhóm VIIA, ví dụ: 919F (1s22s22p5) và 1735Cl (1s22s22p63s23p5).
HD:
a) Lấy 2 nguyên tố khí hiếm, ví dụ: 24He (1s2) và 1020Ne (1s22s22p6).
b) Lấy 2 nguyên tố thuộc nhóm IA, ví dụ: 11H (1s1) và 37Li (1s22s1).
c) Lấy 2 nguyên tố thuộc nhóm VIIA, ví dụ: 919F (1s22s22p5) và 1735Cl (1s22s22p63s23p5).

- Các electron hóa trị của các nguyên tố thuộc nhóm IA, IIA là electron s. Các nguyên tố đó được gọi là nguyên tố s.
- Các electron hóa trị của các nguyên tố thuộc nhóm IIIA, IVA, VA, VIA, VIIA, VIIIA là các electron s và p. Các nguyên tố đó được gọi là nguyên tố p.
- Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố s là 1 và 2. Số electron thuộc lớp ngoài cùng trong nguyên tử của các nguyên tố p là 3, 4, 5, 6, 7, 8.

Đối với các nguyên tố thuộc các nhóm A thì những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tố tương ứng.
Các electron ở lớp ngoài cùng có khả năng, tham gia hình thành liên kết hoá học được gọi là các electron hoá trị.
Thí dụ, cacbon có cấu hình electron : 1 s 2 2 s 2 2 p 2 , các electron 2 s 2 2 p 2 là những electron lớp ngoài cùng và là những electron hoá trị.
a)
1 lớp:H,He
2 lớp:Li, Be, B, C, N, O, F
3 lớp:Na, Mg, Al, Si, P, S, Cl, Ar
4 lớp:K,Ca
b)
1 e ngoài cùng:H, Li, Na, K
2 e ngoài cùng:Be, Mg, Ca
3 e ngoài cùng:B, Al