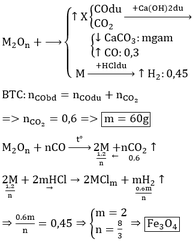
Cho 21,6 gam hỗn hợp A gồm kim loại M và oxit M2O3 được nung ở nhiệt độ cao rồi dẫn luồng khí CO dư đi qua để phản ứng hoàn toàn thu được m gam kim loại và 6,72 lit CO2 . Xác định kim loại M biết tỉ lệ số mol của 2 chất trong hỗn hợp A là 1:1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n H2O = 5,4/18 = 0,3(mol)
$M_2O_3 + 3H_2 \xrightarrow{t^o} 2M + 3H_2O$
n M2O3 = 1/3 n H2O = 0,1(mol)
=> n M = n M2O3 = 0,1(mol)
=> m hỗn hợp = 0,1M + 0,1(2M + 16.3) = 21,6
=> M = 56(Fe)
Vậy M là kim loại Fe, oxit là Fe2O3
b) n Fe = n Fe ban đầu + 2n Fe2O3 = 0,1 + 0,1.2 = 0,3(mol)
=> m = 0,3.56 = 16,8 gam

a)Gọi số mol của M và M2O3 lần lượt là x,y :
⇒ n\(_{O_2}\)=3y=n\(_{CO_2}\)=0,3 ⇒y=0,1
x = y = 0,1⇒0,1M + 0,1(2M + 48) = 21,6 ⇒M=56 ⇒ Fe và Fe2O3
b)⇒ m=(0,1.56) + (0,1.2.56)=16,8(g)

4) x,y lần lượt là số mol của M và M2O3
=> nOxi=3y=nCO2=0,3 => y=0,1
Đề cho x=y=0,1 =>0,1M+0,1(2M+48)=21,6 =>M=56 => Fe và Fe2O3
=> m=0,1.56 + 0,1.2.56=16,8
2)X + 2HCl === XCl2 + H2
n_h2 = 0,4 => X = 9,6/0,4 = 24 (Mg)
=>V_HCl = 0,4.2/1 = 0,8 l

M2O3 + 3CO => 2M + 3CO2
nCO2 = V/22.4 = 6.72/22.4 = 0.3 (mol)
Theo phương trình ==> nM2O3 = 0.1 (mol)
Mà theo đề bài: nM = nM2O3 = 0.1 (mol)
Suy ra ta có: 21.6 = 0.1(M + 2M + 3x16)
216 = 3M + 48 => M = 56 (Fe)
Vậy kim loại M là Fe ( sắt )
Theo phương trình nFe = 0.2 (mol), nFe2O3 = 0.1 (mol) => mFe2O3 = 16 (g)
==> mFe trong hỗn hợp = 21.6 - 16 = 15.6 (g)
mFe phương trình = n.M = 56x 0.2 = 11.2 (g)
mFe = 11.2 + 15.6 = 26.8 (g)

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


Gọi nM = nM2O3 = x (mol)
Ta có: \(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(M_2O_3+3CO\underrightarrow{t^o}2M+3CO_2\)
Theo PT: \(n_{M_2O_3}=\dfrac{1}{3}n_{CO_2}=0,1\left(mol\right)\)
⇒ x = 0,1 (mol)
\(\Rightarrow0,1M_M+0,1\left(2M_M+16.3\right)=21,6\)
\(\Rightarrow M_M=56\left(g/mol\right)\)
Vậy: M là Fe.