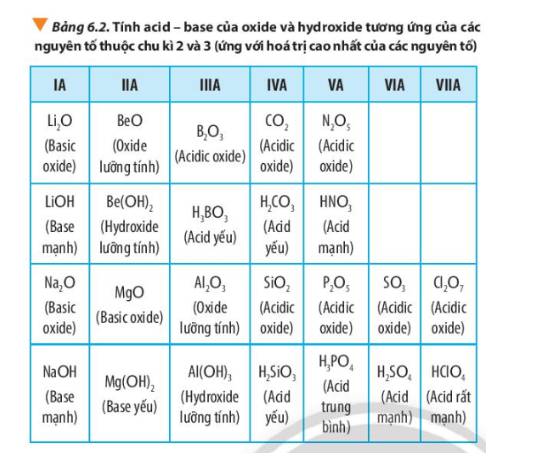
Quan sát Bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid, tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ví dụ: Nguyên tố X thuộc chu kì 3, nhóm VIIA.
⇒ Nguyên tử X có 3 lớp electron và 7 electron lớp ngoài cùng.
⇒ Cấu hình electron của X là 1s2 2s2 2p6 3s2 3p5.
- Do có 7 electron lớp ngoài cùng nên nguyên tố X là phi kim.
- Công thức oxide ứng với hóa trị cao nhất là X2O7 là acidic oxide.
- Công thức hydroxide ứng với hóa trị cao nhất là HXO4 là acid mạnh.

- Trong một chu kì, theo chiều tăng dần điện tích hạt nhân của nguyên tử các nguyên tố:
+ Bán kính: xu hướng giảm dần do điện tích tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn.
+ Tính kim loại có xu hướng giảm dần còn tính phi kim có xu hướng tăng dần. Do lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron của nguyên tố.
+ Độ âm điện: xu hướng tăng dần do điện tích hạt nhân tăng lên, bán kính nguyên tử giảm dần nên khả năng hút cặp e liên kết càng mạnh.
- Trong một nhóm, theo chiều tăng dần điện tích hạt nhân của nguyên tử các nguyên tố:
+ Bán kính: xu hướng tăng dần do số lớp electron tăng dần.
+ Tính kim loại có xu hướng tăng dần còn tính phi kim có xu hướng giảm dần.. Do lực hút của hạt nhân tới electron hóa trị giảm dần, làm tăng khả năng nhường electron.
+ Độ âm điện: xu hướng giảm dần do theo chiều tăng của điện tích hạt nhân, lực hút của hạt nhân tới cặp electron liên kết giảm.
Ghi chú: Các quy luật về xu hướng biến đổi bán kinh, tính kim loại, tính phi kim, độ âm điện của nguyên tử các nguyên tố trong một chu kì và trong một nhóm chỉ áp dụng cho nguyên tố nhóm A.

Để so sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học cần ghi nhớ:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.

Trong bảng tuần hoàn các nguyên tố thì tính phi kim của các nguyên tố biến thiên cùng chiều với độ âm điện của chúng.

Các phi kim được phân bố ở khu vực bên phải trong bảng tuần hoàn.

Các kim loại được phân bố ở khu vực bên trái trong bảng tuần hoàn.
- Trong 1 chu kì:
+ Tính kim loại giảm dần, tính phi kim tăng dần.
+ Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần