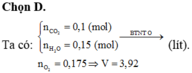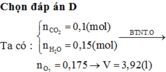1. Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 49,98 kJ. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

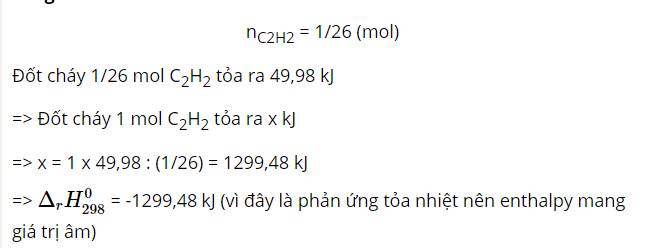

nC2H2 = 1/26 (mol)
Đốt cháy 1/26 mol C2H2 tỏa ra 49,98 kJ
=> Đốt cháy 1 mol C2H2 tỏa ra x kJ
=> x = 1 x 49,98 : (1/26) = 1299,48 kJ
=> ${\Delta _r}H_{298}^0$ = -1299,48 kJ (vì đây là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm)

\(\Delta_rH=-\dfrac{50,01kJ}{\dfrac{1}{26}mol}=-1300,26kJ\cdot mol^{-1}\)
Mặt khác, khi đốt 1 mol methane chỉ toả ra lượng nhiệt khoảng 890,2 kJ, thấp hơn nhiều so với acetylene nên acetylene được dùng trong đèn xì.

\(C_2H_6+\dfrac{7}{2}O_2->2CO_2+3H_2O\\ \Delta_rH^o_{298}=2\left(-393,5\right)+3\left(-285,8\right)-\left(-84,7\right)\\ \Delta_rH^o_{298}=-1559,7kJ\)
Phương trình nhiệt hoá học thì không cần ghi điều kiện nhé.

a) \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn C: nC = 0,4 (mol)
=> \(n_H=\dfrac{5,8-0,4.12}{1}=1\left(mol\right)\)
Xét nC : nH = 0,4 : 1 = 2 : 5
=> CTPT: (C2H5)x
Mà CTPT của X có dạng CnH2n+2
=> x = 2
=> CTPT: C4H10
b)
PTHH: 2C4H10 + 13O2 --to--> 8CO2 + 10H2O
0,65<-------0,4------->0,5
=> \(m_{H_2O}=0,5.18=9\left(g\right)\)
c) \(V_{O_2}=0,65.22,4=14,56\left(l\right)\)

\(\Delta_fH^{^{ }o}_{298}\left[CH_4\right]=-\left(-890,3-\left(-393,5\right)-\left(-285,8\right)\right)\\ \Delta_fH^{^{ }o}_{298}\left[CH_4\right]=211kJ\cdot mol^{-1}\)