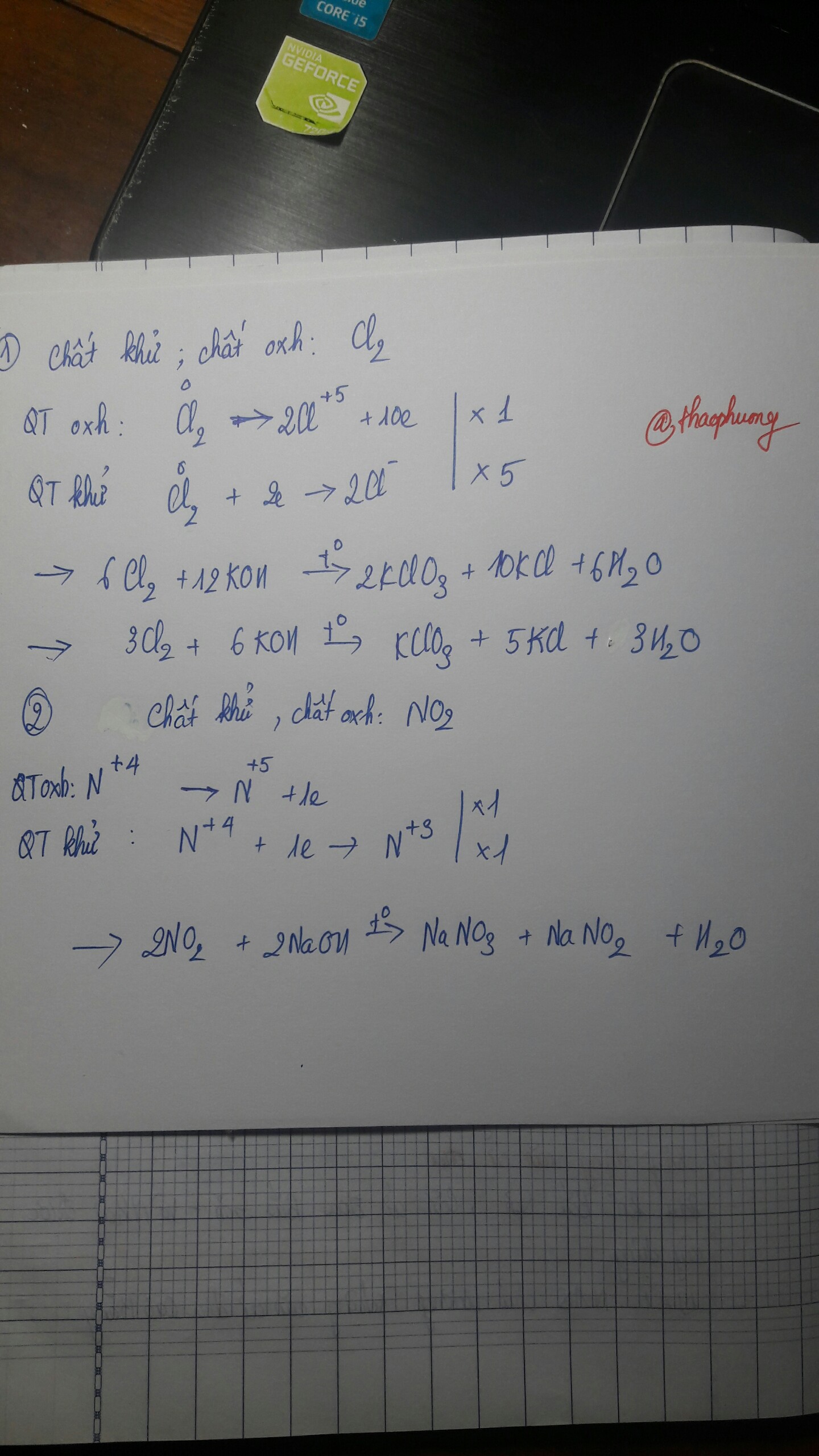Lấy 4 ví dụ và viết phương trình về chuyển hoá các chất trong tự nhiên xác định chất khử và chất oxi hoá
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\({\rm{C}}{{\rm{H}}_{\rm{3}}}\mathop {\rm{C}}\limits^{ + 1} {\rm{H = O + }}{\mathop {{\rm{Br}}}\limits^0 _{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}\mathop {\rm{C}}\limits^{ + 3} {\rm{OOH + 2H}}\mathop {{\rm{Br}}}\limits^{ - 1} \)
Trong phản ứng trên, số oxi hoá của C (trong nhóm chức –CHO) tăng từ +1 lên +3, CH3CHO là chất oxi hóa. Số oxi hóa của Br giảm từ 0 xuống -1 , Br2 là chất oxi hóa.

1. \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Chất khử: KClO3; Chất oxh: KClO3
| QT khử | Cl+5 +6e-->Cl-1 | x2 |
| QT oxh | 2O-2 -4e --> O20 | x3 |
2. 2Mg(NO3)2 --to--> 2MgO + 4NO2 + O2
Chất khử: Mg(NO3)2; Chất oxh: Mg(NO3)2
| QT khử | N+5 +1e --> N+4 | x4 |
| QT oxh | 2O-2 -4e --> O20 | x1 |

1) (5x-2y)Fe + (18x-6y)HNO3 --> (5x-2y)Fe(NO3)3 + 3NxOy + (9x-3y)H2O
Chất khử: Fe
Chất oxh: HNO3
| QT oxh | Fe0 -3e --> Fe+3 | x(5x-2y) |
| QT khử | xN+5 + (5x-2y)--> \(N_x^{+\dfrac{2y}{x}}\) | x3 |
2) 2M + 2nH2SO4 --> M2(SO4)n + nSO2 + 2nH2O
Chất khử: M
Chất oxh: H2SO4
| QT oxh | 2M0 -2ne --> M2+n | x1 |
| QT khử | S+6 + 2e --> S+4 | xn |

3Cl2 + 6KOH --> KClO3 + 5KCl + 3H2O
Chất oxi hóa: Cl2
Chất khử: Cl2
| QT oxh | Cl0 -5e --> Cl+5 | x1 |
| QT khử | Cl0 + 1e --> Cl-1 | x5 |
2NO2 + 2NaOH --> NaNO3 + NaNO2 + H2O
Chất oxh: NO2
Chất khử: NO2
| QT oxh | N+4 -1e --> N+5 | x1 |
| QT khử | N+4 +1e --> N+3 | x1 |

\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)