Cho hỗn hợp A gồm Cu và Fe. cho m gam A vào dd HCl dư thu được 4,48l khí H2 (đktc). Cũng m gam A cho tan hết H2SO4 đặc, nóng dư thu được 10,08l (đktc) khí SO2 (sản phẩm khử duy nhất). Các phản ứng xảy ra hoàn toàn. Tính thành phần % theo khối lượng các kim loại trong A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)
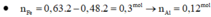
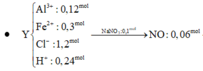
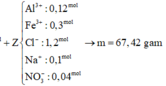
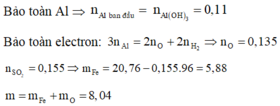
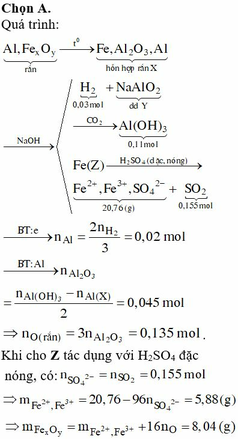

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)