Đem hòa tan 4,8 gam FeSx (hợp chất Y) trong dd H2SO4 đặc, nóng dư thu được SO2 (sp khử duy nhất). Khí SO2 làm mất màu vừa hết 2000 gam dd Br2 2,4%. Xác định CTPT của Y.
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

14 tháng 12 2017
Ta có số mol e kim loại nhường là (19,7 - m)/8 + 0,8
Ta có số mol e nhận tạo khi SO2 là (19,7 -m)/8 + 0,8 => Số mol SO2 là (29,7 - m)/16 + 0,4
Trong phản ӭng với H2SO4 đặc, ta có số mol H2SO4 = số mol H2O = 2 số mol SO2
Áp dụng bảo toàn khối lượng => m = 26,5
=> Đap an C

1 tháng 9 2017


Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3
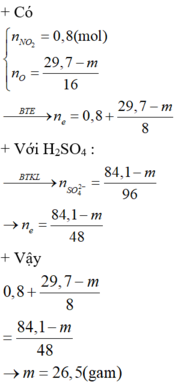
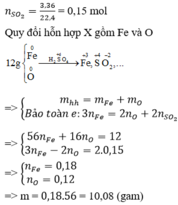
\(SO_2 + Br_2 + 2H_2O \to 2HBr + H_2SO_4\\ n_{SO_2} = n_{Br_2} = \dfrac{2000.2,4\%}{160} = 0,3(mol)\)
Bảo toàn electron :
\((3 + 6x).n_Y = 2n_{SO_2}\\ \Rightarrow n_Y = \dfrac{0,6}{3 + 6x}\\ \Rightarrow \dfrac{0,6}{3 + 6x}.(56 + 32x) = 4,8\\ \Rightarrow x = 2\)
Vậy CTHH của Y : FeS2