Hòa tan hoang toàn 13g một kim loại M hóa trị II vào axit H2SO4 đặc, nóng thu được 4,48l khí SO2 (đktc). Kim loại thu được là A. Mg B. Zn C. Cu D. Fe
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D.
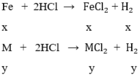
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 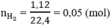
theo bài ra ta có hệ phương trình
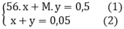
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 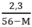
Ta có 0 < y < 0,05
y > 0 ↔ 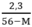 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 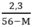 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be

\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(R+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow RSO_4+SO_2\uparrow+2H_2O\)
0,2<-------------------------------------0,2
\(\rightarrow M_R=\dfrac{12,8}{0,2}=64\left(\dfrac{g}{mol}\right)\\ \rightarrow R:Cu\)
Khí thoát ra là SO2
\(R\rightarrow R^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ n_{SO_2}=\dfrac{4,48}{22,4}=0,2\\ Bảotoàne:n_R.2=n_{S^{+4}}.2\\ \Rightarrow n_R=0,2\left(mol\right)\\ \Rightarrow M_R=\dfrac{12,8}{0,2}=64\left(Cu\right)\)

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

Gọi kim loại cần tìm là R hóa trị n
Gọi : nFe = a mol ; nR = b mol
⇒ 56a + Rb = 8,3(1)
Trường hợp 1 : Kim loại R tan trong HCl
\(Fe +2 HCl \to FeCl_2 +H_2\\ 2R + 2nHCl \to 2RCl_n + nH_2\\ n_{H_2} = a + 0,5bn = \dfrac{5,6}{22,4} = 0,25(2)\)
Bảo toàn e :
\(2n_{SO_2} = 3n_{Fe} + n.n_R\\ \Rightarrow 3a + bn = \dfrac{6,72}{22,4}.2 = 0,6(3)\)
Từ (2)(3) suy ra: a = 0,1 ; bn = 0,3 ⇒ b = \(\dfrac{0,3}{n}\)
Ta có :0,1.56 + \(\dfrac{0,3}{n}.R = 8,3\)
Suy ra: R = 9n
Với n = 3 thì R = 27(Al)
Trường hợp 2 : Kim loại R không phản ứng với HCl
\(n_{Fe} = n_{H_2} = 0,25(mol)\\ \)
BT electron :
\(n_R = \dfrac{0,3.2 - 0,25.3}{n} = \dfrac{-0,15}{n}<0\)(Loại)

a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)

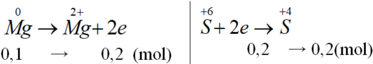
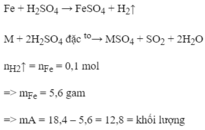

Ta có: \(n_{SO4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ M_M=\dfrac{18}{0,2}=65\)
Vậy kim loại cần tìm là Zn