Cho 2,1 gam hỗn hợp A gồm Al và Mg vào trong 250ml dung dịch X chứa HCl 0,6M và
H2SO4 0,2M, khuấy đều để phản ứng xảy ra hoàn toàn được dung dịch B và V lít H2
(đktc).
a) Chứng minh rằng trong dung dịch B vẫn còn axit.
b) Tính khối lượng của mỗi kim loại trong hỗn hợp A nếu biết V = 2,464.
c) Thêm 140 gam dung dịch Ba(OH)2 17,1% vào dung dịch B. Tính khối lượng kết tủa
thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.Ta có n HCl = 1 . 0,25 = 0,25 mol
nH2SO4 = 0,5.0.25 = 0,125 mol
==> nH(X) = 0,25 + 0,125.2 = 0,5 mol
nH2 = 4,368/22,4 = 0,195 mol <=> nH= 0,195. 2 = 0,39 mol < 0,5 mol
Vậy sau phản ứng dung dịch B vẫn còn axit dư
b. Gọi số mol của Al và Mg lần lượt là x và y mol
Ta có phương trình 27x + 24y =3,87 (1)
Áp dụng định luật bảo toàn eletron ==> 3x + 2y = 0,195.2 (2)
Từ (1) , (2) ==> \(\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
mAl = 0,09 .27 = 2,43 gam , %mAl trong A = \(\dfrac{2,43}{3,87}\).100=62,8%
==> %mMg trong A = 100 - 62,8 = 37,2%

Đáp án A
Chú ý đổ từ từ muối Na2CO3 và NaHCO3 vào dung dịch H2SO4 thì xảy ra đồng thời các phương trình ( HSO4- coi như chất điện ly hoàn toàn tạo ra SO42- và H+)
2H+ + CO32- → CO2 + H2O (1)
2x------> x
H+ + HCO3- → CO2 + H2O (2)
y -----> y
Ta có 2x+ y = 0,08 mol
Vì phản ứng xảy ra đồng thời nên x: y = nCO32- : nHCO3- = 0,06 : 0,03 = 2:1
Ta có hệ 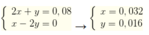
Vậy nCO2 = 0,032 + 0,016 = 0,048 mol → V= 1,0752 l
Vậy dung dịch X chứa : HCO3- dư : 0,014 mol, CO32- :0,028 mol, SO42-:0,06 mol
Khi cho 0,15 mol BaCl2 và 0,06 mol KOH vào dung dịch X xảy ra các pt sau:
HCO3- + OH- → CO32- + H2O
0,014--- 0,06 ----> 0,014
Ba2+ + CO32- → BaCO3↓
0,15 ----0,042 ----> 0,042
SO42- + Ba2+ → BaSO4↓
0,06---------------> 0,06
Vậy mkết tủa = 0,06×233+ 0,042×197 = 22,254 gam

Chọn đáp án C
Tổng nH+ = 0,02 + 0,06 = 0,08 mà có n H C O 3 - = 0,03 và n H C O 3 2 - = 0,06 Þ Tỉ lệ 1: 2
Đặt số mol n H C O 3 - phản ứng = x Þ n H C O 3 2 - phản ứng = 2x Þ x + 2.2x = 0,08
Þ x = 0,08/5 = 0,016
Þ nCO2 = x + 2x = 3x0,016 = 0,048 Þ V = 0,048x22,4 = 1,0752
X lúc này có n S O 4 2 - = 0,06, n B a 2 + = 0,03 - 0,016 = 0,014; n C O 3 2 - = 0,06 - 0,032 = 0,028
Thêm vào X hỗn hợp 0,06 OH- và 0,15 Ba2+ Þ nOH- > n H C O 3 -
Þ Sau phản ứng với OH-, tổng n B a 2 + = 0,014 + 0,028 = 0,042
Vì 0,042 + 0,06 <0,15 Þ Ba2+ dư Þ nBaCO3 = 0,042 và nBaSO4 = 0,06
Vậy m = 0,042x197 + 0,06x233 = 22,254

Đáp án C
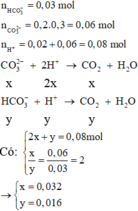
=> V=22,4.(x+y)=1,0752 lít
Dung dịch X chứa 0,028 mol CO 3 2 - , 0,014 mol HCO 3 - , 0,06 mol SO 4 2 - , Na + , K +
Thêm: n OH - = 0 , 06 mol , n Ba 2 + = 0 , 15 mol vào dung dịch X.
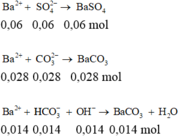
Sau phản ứng dư Ba2+, OH-
n kết tủa = 197 . ( 0 , 028 + 0 , 014 ) + 233 . 0 , 06 = 22 , 254 gam

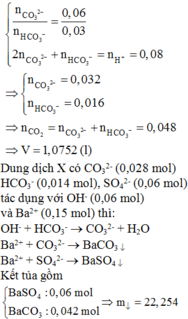
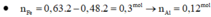
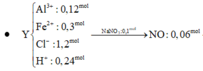
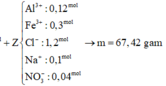
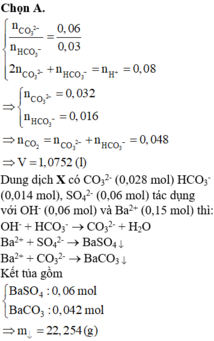
không cần làm bài này nữa đâu ạ
cảm ơn mọi người nhiều