Cho a gam hỗn hợp gồm Fe . Ag vào dung dịch H_{2}*S*O_{4} loãng dư sau phản ứng thu được 2,24 lit khí Il (đkc). Mặt khác cho a gam hỗn hợp trên vào H_{2}*S*O_{4} dậm đặc nóng thu được 5,6 lit khí S*O_{2} (dkc). a) Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu. b Dẫn toàn bộ lượng khí S*O_{2} thu được ở trên vào 250 ml dung dịch NaOH 1,5M thu được muỗi nào sau phản ứng. Tính nồng độ các chất thu được sau phản ứng, biết thể tích dung dịch không đáng kể. (Fe: 56;Ag:108;S:32)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a
\(2Fe+6H_2SO_{4.đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
b
\(2Na+2HCl\rightarrow2NaCl+H_2\)
c
\(8Al+30HNO_3\rightarrow8Al\left(NO_3\right)_3+3NH_4NO_3+9H_2O\)
d
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(Ba\left(OH\right)_2+\left(NH_4\right)_2SO_4\rightarrow BaSO_4+2NH_3+2H_2O\)
e
\(2AlCl_3+3Na_2CO_3+H_2O\rightarrow2Al\left(OH\right)_3+6NaCl+3CO_2\)
f
\(HCl+NaAlO_2+H_2O\rightarrow Al\left(OH\right)_3+NaCl\)
a: \(2Fe+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+3H_2O\)(H2SO4 đặc nóng)
b: \(2Na+2HCl\rightarrow2NaCl+H_2\uparrow\)
c: \(8Al+30HNO_3\rightarrow8Al\left(NO_3\right)_3+3NH_4NO_3+9H_2O\)
d; \(Ba+\left(NH_4\right)_2SO_4\rightarrow BaSO_4\downarrow+2NH_3+H_2O\)
e: \(2AlCl_3+3Na_2CO_3+3H_2O\rightarrow6NaCl+2Al\left(OH\right)_3\downarrow+3CO_2\uparrow\)
f: \(HCl+NaAlO_2+H_2O\rightarrow Al\left(OH\right)_3+NaCl\)

Đáp án : B
Chỉ có Fe phản ứng với axit => nFe =nH2 = 0,1 mol
=> mFe = 5,6g

Gọi \(\left\{{}\begin{matrix}n_{RO}=2x\\n_{Fe_2O_3}=x\end{matrix}\right.\)
Theo đề:
\(R.2x+56.2x=31,56\)
\(\Rightarrow2x.R=31,56-112x\)
Mặt khác: \(2x.\left(R+16\right)+160x=36,36\)
\(\Leftrightarrow2xR+32x+160x=36,6\Leftrightarrow31,56-112x+32x+160x=36,36\)
=> x = 0,06
\(\Rightarrow R=\dfrac{31,56-112.0,06}{2.0,06}=207\)
Vậy kim loại R là Pb (chì).

Đáp án D
Sơ đồ quá trình:
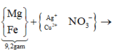
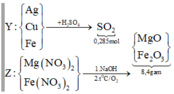
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
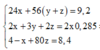
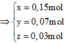
Theo đó, ![]()

a, Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2}=\dfrac{7,28}{22,4}=0,35\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
a--------------------------------------->1,5a
Zn + H2SO4 ---> ZnSO4 + H2
b------------------------------>b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}27a+65b=10,55\\1,5a+b=0,35\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,15.27=4,05\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{4,05}{10,55}.100\%=38,4\%\\\%m_{Zn}=100\%-38,4\%=61,6\%\end{matrix}\right.\)
b, PTHH:
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1------------------------------>0,1----->0,1
\(2Al+3ZnSO_4\rightarrow Al_2\left(SO_4\right)_3+3Zn\downarrow\)
\(\dfrac{1}{15}\)<---0,1---------->\(\dfrac{1}{30}\)---------->0,1
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1----------------------------->0,1-------->0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\x=\dfrac{1}{30}.342+0,1.161=27,5\left(g\right)\end{matrix}\right.\)
\(a.Đặt:\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ \Rightarrow\left\{{}\begin{matrix}27x+65y=10,55\left(g\right)\\\dfrac{3}{2}x+y=\dfrac{7,28}{22,4}=0,325\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,15.27}{10,55}.100=38,39\%;\%m_{Zn}=61,61\%\\ b.X+H_2SO_4đặc,nguội\Rightarrow ChỉcóZnphảnứng\\ Zn\rightarrow Zn^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ Bảotoàne:n_{Zn}.2=n_{SO_2}.2\\ \Rightarrow n_{SO_2}=0,1\left(mol\right)\\ \Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\\ n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{ZnSO_4}=161.0,1=16,1\left(g\right)\)
Lưu ý: Al bị thụ động với H2SO4 dặc nguội
a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4(l) ---> FeSO4 + H2
0,1<-------------------------------0,1
\(m_{Fe}=0,1.56=5,6\left(g\right)\\ n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH:
2Fe + 6H2SO4(đ,n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1-------------------------------------------->0,15
2Ag + 2H2SO4(đ,n) ---> Ag2SO4 + SO2 + 2H2O
0,2<----------------------------------------0,1
=> mAg = 0,2.108 = 21,6 (g)
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+21,6}.100\%=20,44\%\\\%m_{Ag}=100\%-20,44\%=79,56\%\end{matrix}\right.\)
b) nNaOH = 0,25.1,5 = 0,375 (mol)
\(T=\dfrac{0,375}{0,25}=1,5\) => Tạo cả 2 muối
PTHH:
2NaOH + SO2 ---> Na2SO3 + H2O
0,375--->0,1875--->0,1875
Na2SO3 + SO2 + H2O ---> 2NaHSO3
0,0625<---0,0625----------->0,125
=> \(\left\{{}\begin{matrix}C_{M\left(Na_2SO_3\right)}=\dfrac{0,1875-0,0625}{0,25}=0,48M\\C_{M\left(NaHSO_3\right)}=\dfrac{0,125}{0,25}=0,5M\end{matrix}\right.\)