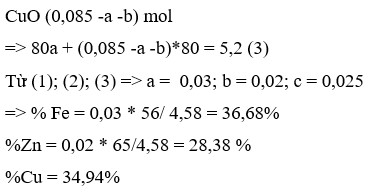Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
Quy A về Cu, Al, Fe và O || [O] + H2SO4 → SO42– + H2O ⇒ nO = nH2SO4 = 0,17 mol.
H2 + [O] → H2O (trừ Al2O3) ⇒ nAl2O3 = (0,17 - 0,08)/3 = 0,03 mol ⇒ nAl = 0,06 mol.
||► Rắn gồm 0,03 mol Al2O3 và Fe2O3 ⇒ nFe2O3 = (6,66 - 0,03 × 102)/160 = 0,0225 mol
⇒ nFe = 0,045 mol ⇒ nCu = (8,14 - 0,06 × 27 - 0,045 × 56 - 0,17 × 16)/64 = 0,02 mol.
⇒ nO/oxit sắt = 0,17 - 0,09 - 0,02 = 0,06 mo ⇒ Fe : O = 0,045 : 0,06 = 3 : 4 ⇒ Fe3O4
⇒ moxit sắt = 0,015 × 232 = 3,48(g) ⇒ chọn A.

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

Đáp án A
FeO , Fe 2 O 3 , Fe 3 O 4 → + HCl FeCl 2 , FeCl 3 → + NaOH , t o Fe 2 O 3


nO/X = (5,92 – 4,16) ÷ 16 = 0,11 mol
[O] + 2HCl → 2Cl + H2O ⇒ nCl– = 2nO = 0,22 mol.
Đặt nMg = x; nFe = y ⇒ 24x + 56y = 4,16(g).
Rắn gồm x mol MgO và 0,5y mol Fe2O3
⇒ 40x + 160.0,5y = 6(g)
⇒ giải hệ có: x = 0,01 mol; y = 0,07 mol.
Bảo toàn electron cả quá trình:
2nMg + 3nFe = 2nO + nAg ⇒ nAg = 2 × 0,01 + 3 × 0,07 - 2 × 0,11 = 0,01 mol.
► Kết tủa gồm 0,01 mol Ag và 0,22 mol AgCl
⇒ m = 0,01 × 108 + 0,22 × 143,5 = 32,65(g).
Đáp án C

Cách 1: Trước hết ta tóm tắt sơ đồ phản ứng để dễ dàng nắm bắt nội dung của bài toán:
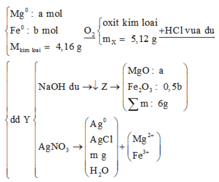
+ Bảo toàn nguyên tố Mg: nMgO = nMg = a mol
+ Bảo toàn nguyên tố Fe:
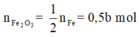
Bây giờ ta đi tìm a, b.
+ Từ đó ta có hệ:
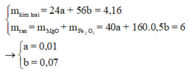
+ Bảo toàn khối lượng: mO(X) = 5,92 - 4,16 = 1,76 g
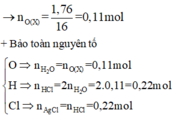
+ Như vậy ta có: mkết tủa =mAg + mAgCl , mà đã có được nAgCl, nên công việc của ta là đi tính khối lượng Ag.
Để tính được Ag, ta cần phải xác định được các trạng thái số oxi hóa của các nguyên tố có sự thay đổi số oxi hóa là Mg, Fe, O và Ag, dựa vào sơ đồ phản ứng ở trên ta dễ dàng tính được mAg.
+ Bảo toàn electron ta có các quá trình
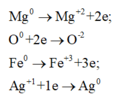
+ Do đó 2nMg + 3nFe = 2nO(X) + nAg
⇒2.0,01+ 3.0,07 = 2.0,11+nAg ⟹nAg =0,01 mol
Suy ra mkết tủa = mAg +mAgCl =0,01.108 + 0,22.143,5 = 32,65 g
Cách 2: Ta sẽ không cần tìm a, b như trên, thay vào đó ta sẽ sử dụng giả thiết “hỗn hợp X chỉ gồm các oxit” :
+ Nung Z trong không khí được 6 gam chất rắn là Fe2O3.
+ Bảo toàn khối lượng: mO(X) = 5,92 - 4,16 = 1,76 g
+ Bảo toàn nguyên tố:
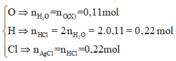
+ Tương tự như trên ta cần phải tính được nAg, dễ thấy 6 g rắn khi nung Z > mX(5,92)
⇒ Trong X phải có FeO, vì “hỗn hợp X chỉ gồm các oxit” nên ta coi X chỉ gồm 2 oxit là FeO và Fe2O3.
Do đó khối lượng O dùng để oxi hóa Fe2+ trong X thành Fe3+ là:
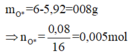
+ Như vậy bảo toàn electron, thì số mol:
+ Nên nAg = nFe2+ = 2nO = 2.0,005 = 0,01 mol
⇒ m↓ = mAg +mAgCl =0,01.108 + 0,22.143,5 = 32,65 g
Đáp án A

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%