Cho 7,1 gam khí clo tác dụng với 13 gam thu được chất rắn X. Cho X tác dụng với AgNO3 dư. Tính khối lượng kết tủa thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{9,45}{27}=0,35\left(mol\right)\\ PTHH:2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\\ \left(mol\right)...0,35\rightarrow........0,35\\ PTHH:AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\downarrow\\ \left(mol\right)....0,35\rightarrow..........................1,05\\ m_{AgCl}=1,05.143,5=150,675\left(g\right)\)

Đáp án A
Bài này có thể giải theo kinh nghiệm,
hoặc biện luận rào số mol hỗn hợp A.
Từ đó ⇒ giới hạn của chất rắn C
Trường hợp xả ra đó là:
Fe pứ hết và Cu chỉ pứ 1 phần
⇒ C gồm Ag và Cu chưa tan.
+ Sơ đồ ta có:
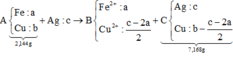

PT theo khối lượng oxit:
40c = 2,56 Û c = 0,064 mol
⇒ CM AgNO3 = 0,064 ÷ 0,2 = 0,32

Bài này có thể giải theo kinh nghiệm, hoặc biện luận rào số mol hỗn hợp A.
Từ đó ⇒ giới hạn của chất rắn C
Trường hợp xả ra đó là:
Fe pứ hết và Cu chỉ pứ 1 phần ⇒ C gồm Ag và Cu chưa tan.
+ Sơ đồ ta có:
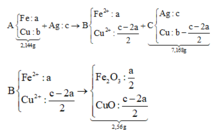
PT theo khối lượng oxit: 40c = 2,56 Û c = 0,064 mol
⇒ CM AgNO3 = 0,064 ÷ 0,2 = 0,32
Đáp án A

Đáp án C
Sau phản ứng thu được hỗn hợp kim loại C => Chứng tỏ C chứa Ag, Cu, có thể có Fe dư, Al dư.
Có khối lượng chất rắn thu được ở phần 1 nhiều hơn phần 2 => Chứng tỏ trong dung dịch ngoài Al(NO3)3 còn chứa Fe(NO3)2
=> Al, Cu(NO3)2 và AgNO3 phản ứng hết, Fe có thể còn dư.
Đặt số mol Cu(NO3)2 và AgNO3 lần lượt là a, b.
Đặt số mol Al và Fe phản ứng lần lượt là x, ỵ
Chất rắn thu được ở phần 2 là Fe2O3 => 160.0,5y = 6,2 => y = 0,15
Chất rắn thu được ở phần 1 là Al2O3 và Fe2O3
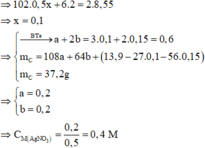

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lý => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol; y = 0,06 mol
=> rắn gồm 0,07 mol MgO và 0,03 mol F e 2 O 3 => m = 7,6 (g)

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư => C u 2 + hết
Giả sử chỉ có Mg phản ứng

Bảo toàn khối lượng gốc kim loại:
![]()
![]()
=> rắn gồm 0,07 mol MgO và 0,03 mol
![]()
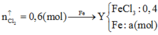
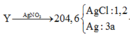


13g Zn đko ?
\(n_{Cl_2}=\dfrac{7,1}{71}=0,1\left(mol\right)\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + Cl2 --to--> ZnCl2
LTL: 0,2 > 0,1 => Zn dư
Theo pthh: nZn (pư) = nZnCl2 = nCl2 = 0,1 (mol)
=> nZn (dư) = 0,2 - 0,1 = 0,1 (mol)
PTHH:
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\downarrow\)
0,1----------------------------------->0,2
\(ZnCl_2+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2AgCl\downarrow\)
0,1----------------------------------------->0,2
=> mkết tủa = 0,2.108 + 0,2.143,5 = 50,3 (g)