Một hỗn hợp X gồm khí c 3 h 4 c 3 h 6 c 3 h 8 đốt cháy hoàn toàn 8,96 lít hỗn hợp X thì phải dùng hết v lít khí oxi thu được m gam CO2 và 19,8 gam nước biết rằng thể tích các khí được đo ở điều kiện tiêu chuẩn a tính m và V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_X=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(n_{H_2O}=\dfrac{19.8}{18}=1.1\left(mol\right)\)
\(n_{CO_2}=3n_X=3\cdot0.4=1.2\left(mol\right)\)
\(m_{CO_2}=1.2\cdot44=52.8\left(g\right)\)
\(\text{Bảo toàn O : }\)
\(n_{O_2}=n_{CO_2}+\dfrac{1}{2}n_{H_2O}=1.2+\dfrac{1}{2}\cdot1.1=1.75\left(mol\right)\)
\(V_{O_2}=1.75\cdot22.4=39.2\left(l\right)\)

Chọn đáp án D
nO2 phản ứng = 0,5875 mà nSO2 (X) tạo thành = 0,4 Þ nO trong Y = 0,5875x2 - 0,4x2 = 0,375
Þ nFe2O3 = 0,375/3 = 0,125 Þ nFe thu được sau khi khử Y = 0,125x2 = 0,25
Vậy m = 0,25x56 = 14.

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{17,92}{22,4}=0,8\left(mol\right)\left(1\right)\)
\(n_{H_2O}=2n_{CH_4}+2n_{C_2H_4}=2x+2y=\dfrac{10,8}{18}=0,6\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
%V cũng là %n ở cùng điều kiện nhiệt độ và áp suất.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,1+0,2}.100\%\approx33,33\%\\\%V_{C_2H_4}\approx66,67\%\end{matrix}\right.\)
b, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(n_{Br_2}=n_{C_2H_4}=0,2\left(mol\right)\Rightarrow V_{ddBr_2}=\dfrac{0,2}{0,5}=0,4\left(l\right)=400\left(ml\right)\)

a, Ta có: \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
m = mC + mH = 0,4.12 + 1,2.1 = 6 (g)
b, Theo ĐLBT KL, có: m + mO2 = mCO2 + mH2O
⇒ mO2 = 22,4 (g) \(\Rightarrow n_{O_2}=\dfrac{22,4}{32}=0,7\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,7.22,4=15,68\left(g\right)\)
\(\Rightarrow V_{kk}=\dfrac{15,68}{20\%}=78,4\left(g\right)\)

nC = 4,8/12 = 0,4 mol
nS = 6,4/32 = 0,2 mol
a. C + O2 -> (nhiệt độ) CO2
S + O2 -> (nhiệt độ) SO2
nO2 = nC + nS = 0,6 mol
=> nN2 = 4 x nO2 = 2,4 mol
=> n không khí = 3 mol => V = 67,2 L
b. mB = 44 x 0,4 + 64 x 0,2 = 30,4 g
nB = 0,6 mol
=> M(trung bình của B) = 30,4/0,6 = 50,67 g/mol

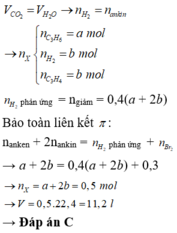
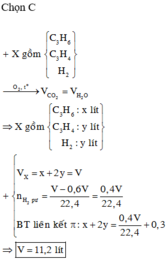
Một hỗn hợp X gồm các khí C\(_3\)H\(_4\), C\(_3\)H\(_6\), C\(_3\)H\(_8\). Đốt cháy 8,96 lít hỗn hợp X cần dùng V lít khí... - Hoc24
Anh có giải bài này ở đây rồi , em tham khảo nhé !