Cho 2,3g Na tan hết trong 47,8ml nước thu được dung dịch NaOH và có khí H2 thoát ra. Tính nồng độ % của dung dịch NaOH?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mH2O = 47,8 . 1 = 47,8 (g)
nH2O = 47,8/18
nNa = 2,3/23 = 0,1 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2
0,1 ---> 0,1 ---> 0,1 ---> 0,05
mNaOH = 0,1 . 40 = 4 (g)
mH2 = 0,05 . 2 = 0,1 (g)
mdd (sau p/ư) = 47,8 + 2,3 - 0,1 = 50 (g)
C%NaOH = 4/50 = 8%
ĐỀ hỏi nồng độ mol hay nồng độ chất tan vậy, nếu hỏi nồng độ chất tan thì đề lỗi

Na+ H2O ------> NaOH+ 1/2H2
0.1.....0.1...............0.1.........0.05
nNaOH=0.1 mol
mH2O=47.8*1=47.8 g (m=D*V)
mdd=47.8+2.3=50.1 g
=>C%NaOH=\(\dfrac{40\cdot0.1\cdot100}{50.1}\)=7.98%
Sau phản ứng có khí H2 thoát ra khỏi dung dịch nên khối lượng dung dịch được tính như sau:
mdd = mNa + mH2O -mH2

nNa = 2,3 : 23 = 0,1 mol
2Na +2 H2O -----> 2NaOH + H2
1mol ---- 1mol ----- 1mol ------ 0.5mol
Theo PT nNa = n NaOH = 0,1mol
n H2 = 1/2 n Na =0,1/2 = 0,05 mol
mNaOH = 0,1 . 40 = 4 gam
mH2 = 0,05 , 2 = 0,1 gam
m H2O = 47,8 gam
m dd = mH2O + mNa - mH2 =47,8 +2,3 - 0,1 = 50 gam
C% = \(\dfrac{4}{50}\) .100% = 8%

nNa = 9.2/23 = 0.4 (mol)
2Na + 2H2O => 2NaOH + H2
0.4.........................0.4.......0.2
VH2 = 0.2 * 22.4 = 4.48 (l)
mNaOH = 0.4 * 40 = 16 (g)
mdd = 9.2 + 100 - 0.2 * 2 = 108.8 (g)
C% NaOH = 16 / 108.8 * 100% = 14.71%
PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaOH}=0,4\left(mol\right)\\n_{H_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,4\cdot40=16\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Na}+m_{H_2O}-m_{H_2}=108,8\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\dfrac{16}{108,8}\cdot100\%\approx14,71\%\)

\(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(pthh:2Na+2H_2O->2NaOH+H_2\)
0,4 0,4 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\\ m_{NaOH}=0,4.40=16\left(G\right)\)

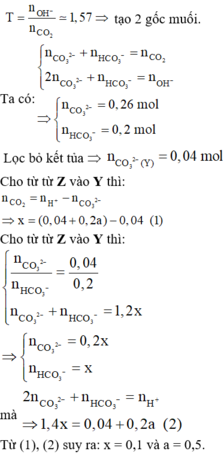


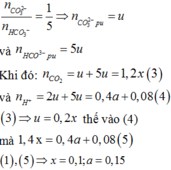
\(n_{Na}=\dfrac{2.3}{23}=0,1\left(mol\right)\)
PTHH : 2Na + 2H2O -> 2NaOH + H2
0,1 0,1 0,1 0,05
\(m_{NaOH}=0,1.40=4\left(g\right)\)
\(m_{H_2O}=47,8\left(g\right)\)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)
\(m_{dd}=47,8+2,3-0,1=50\left(g\right)\)
\(C\%_{NaOH}=\dfrac{4}{50}.100\%=8\%\)
\(47,8ml=47,8g\)
\(n_{Na}=\dfrac{2,3}{23}=0,1mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,1 0,1 0,05 ( mol )
\(m_{NaOH}=0,1.40=4g\)
\(m_{dd}=2,3+47,8-0,05.2=50g\)
\(C\%_{NaOH}=\dfrac{4}{50}.100=14\%\)