Câu 1: Chọn chất thích hợp vào chỗ trống và hoàn thành các phương trình sau.
a) H2 + O2 ![]() ............ b) SO3 + H2O ® ………..
............ b) SO3 + H2O ® ………..
c) CaO + H2O ® .................. d) Fe2O3 + H2 ![]() …….+ H2O
…….+ H2O
e) SO3 + H2O ® ................... g) Fe + H2SO4 ® ............ + H2
h) H2 + PbO ![]() ............ i) SO2 + H2O ® ………..
............ i) SO2 + H2O ® ………..
k) Fe + HCl ® ............ + H2 l) BaO + H2O ® .................
Câu 1: Chọn chất thích hợp vào chỗ trống và hoàn thành các phương trình sau.
a) H2 + O2 ![]() ............ b) SO3 + H2O ® ………..
............ b) SO3 + H2O ® ………..
c) CaO + H2O ® .................. d) Fe2O3 + H2 ![]() …….+ H2O
…….+ H2O
e) SO3 + H2O ® ................... g) Fe + H2SO4 ® ............ + H2
h) H2 + PbO ![]() ............ i) SO2 + H2O ® ………..
............ i) SO2 + H2O ® ………..
k) Fe + HCl ® ............ + H2 l) BaO + H2O ® .................

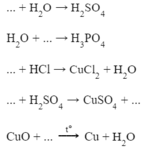
a) 2H2 + O2 --to--> 2H2O
b) SO3 + H2O --> H2SO4
c) CaO + H2O --> Ca(OH)2
d) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
e) SO3 + H2O --> H2SO4
g) Fe + H2SO4 --> FeSO4 + H2
h) H2 + PbO --to--> Pb + H2O
i) SO2 + H2O --> H2SO3
k) Fe + 2HCl --> FeCl2 + H2
l) BaO + H2O --> Ba(OH)2